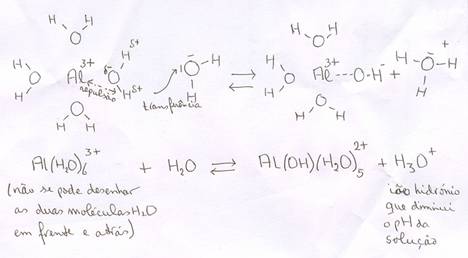
Certos iões com cargas positivos 2+ ou 3+ têm a propriedade de atrair fortemente as moléculas de água. Ou seja, ácidos catiónicos somente existem no meio aquoso.
Estes iões atraem os lados negativos (δ-) das moléculas de água, criando uma repulsão aos átomos de Hidrogénio (que têm uma carga δ+).
ácido catiónico (=ião positivo de um metal) com água  base conjugada + iões hidrónio.
base conjugada + iões hidrónio.
Assim cria-se a possibilidade de cedência de H+.
São alguns iões multipositivos, logicamente dos metais: Al3+, Cu2+, Fe2+ ou Fe3+, e outros.
Exercício 12
Qual é a lógica que diz: ácidos catiónicos - de modo geral - são soluções com iões multipositivos metálicos?
Resposta 09-12
Um caso especial dum ião positivo com carácter ácido é o ião amónio:
NH4+ + H2O
Exercício 13
Explique qual lado deste equilíbrio domina; porquê assim e qual a consequência na prática?
voltar ao curso