Análise dos elementos na Química de Carbono
Um composto de Carbono (química orgânica) sempre contem C, muitas vezes H e talvez O. Outros elementos como N e S deixamos fora desta conversa. A fórmula da substância a investigar pode ser, p.ex.: CxHyOz
Na análise dos elementos determinamos a quantidade de C e H em (mili)gramas. Uma vez que antecipadamente já foi determinada a massa total da substância, podemos ver automaticamente se sim ou não existia O no composto, e quanto.
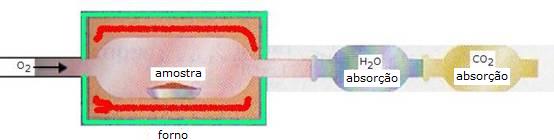
- exactamente e precisamente pesamos uma quantidade bem definida da substância a investigar (uma amostra). Depois queimamos esta amostra completamente com muito oxigénio; todo Carbono é transferido em CO2 e todo H (hidrogénio) em H2O.
- Pesamos a quantidade do dióxido de carbono e da água.
- Da quantidade de dióxido de carbono calcula-se a quantidade de C.
- Da quantidade de água calcula-se a quantidade de H.
- Agora podemos controlar se ainda existia O na substância; caso sim, conhecemos a quantidade: Quando a quantidade original da substância pesada seja mais do que a soma de C + H, a substância deve conter O.
Agora conhecemos a proporção de massa C : H (: O)
Aquela proporção de masse temos que converter na proporção molar: dividir pelas massas atómicas dos elementos C, H (en O). Desta maneira chegamos à proporção x : y : z
Exercício 14:
Explique que da mesma maneira somente pode determinar a fórmula de proporção (CxHyOz)n e não fórmula molecular verdadeira CxHyOz.
O gás dióxido de carbono e a água que temos que determinar na alálise de elementos podemos recolher e pesar da seguinte maneira:
-
Primeiro recolhemos a água(g) através de uma substância higroscópica que pesamos antes e depois da experiência. Para tal podemos aplicar, p.ex. Cloreto de Cálcio seco ou sulfato de cobre seco.
-
Depois recolhemos o gas dióxido de carbono p.ex. com uma base forte como cal. Também este cal pesamos antes e depois da experiência. A diferença é a massa do gás captado.
Exercício 15:
Alguem queima 100 cc de gasolina em oxigénio em excesso, seco e puro. Os produtos de combustão guiamos successivamente através de cloreto de cálcio seco e cal seco. O tubo com cal aumento 220 gr de massa en o tubo com cloreto de cálcio 102 gr. Depois 10 cc de gasolina são dissolvidos em 100 gr de acetono; isto causa um novo ponto de ebulição: 57,40°C.
Determine a fórmula molecular desta gasolina.
voltar ao curso
