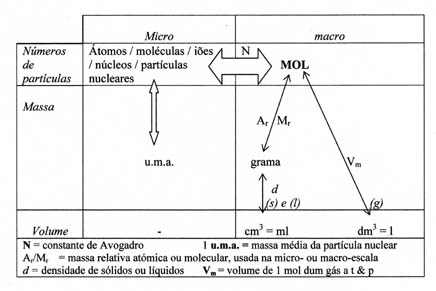
No caso de gases (queremos conhecer o volume de 1 mol gás, por exemplo), o cálculo é bastante diferente. Há uma diferença fundamental entre gases a um lado e líquidos e sólidos ao outro lado.
Ponto especial dos gases é: todas as partículas ficam soltas uma da outra; podem choquar, mas ficam livres.
Portanto, o volume do gás não depende assim do tamanho das partículas. Muito mais depende da distância entre as partículas.
O que conta é: qual a distância entre as moléculas do gás?
Nos líquidos e sólidos, as moléculas ficam juntas. (Quase) não há distância.
No caso de (s) ou (l) a pergunta é: qual o tamanho das moléculas?
Maior as moléculas, maior o volume que ocupam.
No caso de gases é totalmente diferente!!
O volume de um gás, portanto, a distância entre as moléculas gasosas, depende muito (talves exclusivamente) da pressão e da temperatura:
- A pressão mais alto, as moléculas gasosas ficam mais perto, a distância fica menor e haverá mais moléculas por litro = também mais mol/l.
Assim também o gás obtem mais massa, é mais pesado.
- A uma temperatura mais alta (i.é. as partículas movem mais agitadas), as moléculas obtêm mais distância umas das outras. Assim temos menos moléculas de gás por litro, menos mol/l. um litro de gás quente será mais leve do que um litro mo mesmo gás mais frio.
À temperatura de 0°C e 1 atm. de pressão, o volume de 1 mol gás = 22,4 litros, independente do tipo de gás. A uma temperatura e pressão diferente, o volume é diferente, mais igual para qualquer gás. (por exemplo: a 100°C e 1 atm. cada gás tem um volume de 27 litros).
Com ajuda da lei de gás podemos calcular quantos litros constitui uma mol de gás a certa temperatura e pressão. Para tal temos uma equação matemática.
Obtemos de dois gases um volume igual a temperatura e pressão iguais, dentro existem números iguais de moles e números iguais de moléculas, tanto faz qual é o gáz. (veja figura)
Na conversa de unidades, o conceito de MOL fica no centro. O esquema deve conhecer de cor e aplicar rapidamente.
Exercício 10:
Um carro usa 1 litro em 15 km.
Quantos mol de gasolina são usadas depois de 200 km?
voltar ao curso