3.1 Uso de eléctrodos
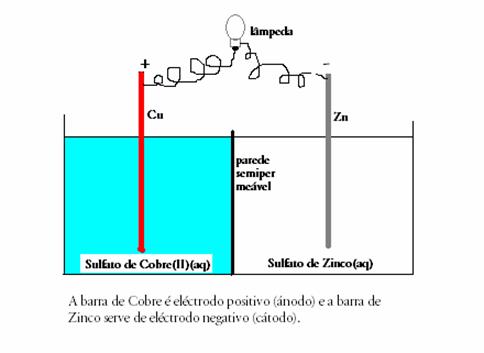
Esboço duma célula química 'cobre/zinco’ com parede semipermeável. Estude bem este esboço.
As reacções (espontâneas) que dominam são:
Zn(s) < Zn2+ + 2e-
Zn2+ + 2e-
e
Cu2+ + 2e-  Cu(s)
Cu(s)
(veja parágrafo 3.3)
A realização duma reacção REDOX às superfícies dos eléctrodos necessita de energia de activação.
O acontecimento na superfície do eléctrodo pode ser exotérmico ou endotérmico, mas quase sempre exige uma certa quantidade de energia para arrancar, chamada 'energia de activação’.
Assim, a formação de gas, por exemplo, em geral custa bastante energia de activação.
Exercício 26
Imagine um ião de cobre(II) que chega a um eléctrodo, formando lá um átomo de cobre, supondo que existe energia de activação suficiente.
Dá a semi-equação; este eléctrodo tornar-se-á positivo ou negativo? Porquê? Quais as observações?
Reacções redox indirectas somente decorrem quando existe dentro dos eléctrodos um meio conduzível (onde se encontram, para tal, iões livres dos electrólitos dissolvidos ou fundidos).
Portanto, enquanto que os electrões são transferidos externamente (por fios eléctricos), entre os dos eléctrodos encontram-se iões livres que podem mover para o eléctrodo positivo (no caso de iões negativos) ou para o eléctrodo negativo (no caso de iões positivos).
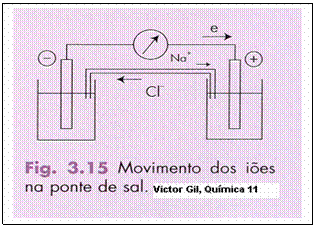
O movimento dos iões livres apenas será possível quando haverá contacto entre os dois líquidos ou soluções.
Este contacto entre as soluções pode ser realizado por uma ponte salina ou por uma parede semipermeável.
Exercício 27
Observe bem o esquema e explique todos os processos que decorrem.
Um eléctrodo pode ter falta de electrões o que causa um eléctrodo positivo, chamado ánodo
Um eléctrodo pode ter excesso de electrões o que causa um eléctrodo negativo, chamado cátodo
Cátodo-Negativo/Ánodo-Positivo (CNAP)
Exercício 28
Aniões e catiões
- O que são?
- Terão que carga? Explique a sua resposta.
Eléctrodos são constituídos por material que conduz, em geral é: um metal ou grafite.
Estas substâncias contêm electrões livres numa rede metálica.
Os electrões livres podem mover livremente (do lado negativo para o lado positivo).
Exercício 29
Eléctrodo líquido:
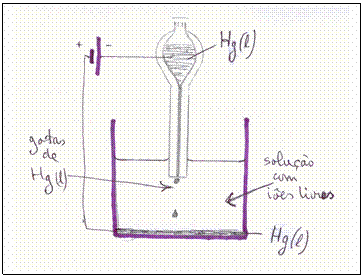
Existe um tipo eléctrodo que não é constituído por uma substância sólida, mas líquida.
- Explique este eléctrodo (veja o esboço), sua função.
- O que pode ser uma grande vantagem deste eléctrodo?
Exercício 30
- Explique porquê metais e grafite conduzem electricidade.
- Explique porquê eléctrodos de cobre ou ferro reagem como redutores.
- Dá um exemplo duma substância fundida que pode conduzir corrente eléctrica.
- Explique se água destilada conduz sim ou não a corrente eléctrica.
Resposta 10-30
Eléctrodos inertes e participativos:
Quando o material do eléctrodo é do tipo 'muito fraco', este eléctrodo é chamado INERTE. Somente transfere electrões, mas não participa na própria reacção redox.
Exemplos de eléctrodos inertes são: ouro, plátina, grafite.
Por outro lado, existem eléctrodos constituídos por material que participa, por exemplo no caso dum eléctrodo de ferro.
Uma barra de ferro pode bem servir de eléctrodo num processo redox indirecto, mas provavelmente vai enviar iões de ferro à solução, enquanto que
os electrões ficam na barra. Assim, pouco a pouco, a barra de ferro desaparece.
Neste exemplo, o redutor da reacção redox é o próprio ferro do eléctrodo e a semi-equação é:
Fe  Fe2+ + 2e-
Fe2+ + 2e-
- Fe é o ferro do eléctrodo
- Os iões Fe2+ entram na solução e vão mover-se para o eléctrodo negativo
- Os electrões ficam na barra e participam na transferência indirecta
O eléctrodo participativo é sempre fabricado de metais neutros e não nobres; servem de redutores, ou seja, podem ceder electrões.
Exercício 31
- porquê não-metais e substâncias iónicas não servem de material de eléctrodo e porquê metais e grafite sim servem?
- porque é que o metal sódio nunca servirá de eléctrodo numa solução salgada?
Exercício 32
Explique porque é que o eléctrodo participativo apenas participa como anode e nunca como katode.
Além do próprio eléctrodo, ánodo ou cátodo, pode-se definir o 'espaço do eléctrodo' o que é a parte do espaço em volta do eléctrodo,
incluindo o seu superfície onde decorrem as reacções.
Pode ser que o espaço do ánodo e do cátodo não tenham uma separação física; existe somente uma única solução.
Para ter certeza de que as concentrações fiquem iguais em toda a solução, acontece que durante o processo agita-se a solução.
Por outro lado, muitas vezes o processo deve decorrer sem misturar os dois espaços, ao contrário;
toma-se medidas para evitar muito transporte de iões essenciais de um lado para o outro.
Pode ser que separam simplesmente os dois espaços out colocam um membrano semipermeável.
Mas a separação completa cria outro problema de já não ter um circuito eléctrico aberto (i.é, um circuito interrupto.
A resolução para tal é uma ponte salina, ponte de sal num gel, cheio de iões móveis, que garantem um circuito fechado (sem interrupção).
Deve-se garantir de que as substâncias (o sal) na ponte não participe no processo, nas reacções redox.
Separar os espaços dos eléctrodos pode ser necessário a fim de evitar certas reacções secundárias pelos produtos, por exemplo, a formação dum precipitado ou dum gás.\
Uma solução (ou uma substância líquida) apenas conduz a electricidade sob condição da presença de partículas carregadas (iões neste caso).
A mobilidade das iões defina a conditibilidade: quanto melhor a mobilidade dos iões, tanto melhor a condutibilidade.
Aquela mobilidade depende muito (não só) do número e do tamanho dos iões. De modo geral, a condutibilidade será muito boa com muitos iões pequenos.
Existem iões (em particular o iõa H+) que têm uma condutibilidade enorme; eles possuem melhores técnicas de mover numa solução aquosa.
Exercício 33
Explique por que é que um metal ou grafite não podem servir de ponte salina.
voltar ao curso