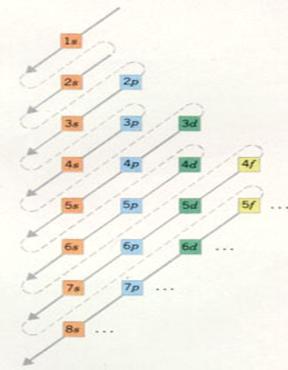
| Camada 1 é constituída por um subnível, |
tipo s |
com número máximo de electrões: |
2 |
| Camada 2 divide-se em duas subníveis |
tipo s p |
com números máximos de electrões: |
2 6 |
| Camada 3 divide-se em três subníveis |
tipo s p d |
com números máximos de electrões: |
2 6 10 |
| Camada 4 divide-se em quatro subníveis |
tipo s p d f |
com números máximos de electrões: |
2, 6 , 10, 14 |
|
Camadas 5 - 7 teoricamente podiam dividir-se em 5 até 7 subníveis, mas átomos tão grandes não existem |
| Camada 5 divide-se em quatro subníveis |
tipo s p d f |
com números máximos de electrões: |
2, 6, 10, 14 |
| Camada 6 divide-se em três subníveis |
tipo s p d |
com números máximos de electrões: |
2, 6, 10 |
| Camada 7 divide-se em dois subníveis |
tipo s p |
com números máximos de electrões: |
2 6 |