Existem reacções completamente espontâneas, tal como no caso de radioactividade natural, mas na maioria dos casos é necessária uma acção para chegar a uma reacção: a acção pode ser: Acender ou aquecer, luz, movimento, juntar com outra substância, electricidade e outros.
Exercício 23
Descreve os processos que acontecem ao acender um fósforo
2.2 Energia da reacção; exotérmico & endotérmico
Cada substância contém uma certa quantidade de energia (química). Os sítios mais sensíveis para a armazenagem desta energia são as ligações entre os átomos dentro da substância.
As ligações podem conter muita energia, por exemplo na biologia, nos seres vivos, as ligações activadas nas moléculas de ATP ou ADP.
Outras substâncias podem conter pouca energia; são as substâncias mais estáveis.
Numa reacção química, os reagentes (com sua própria quantidade de energia química) mudam para produtos (que têm outro conteúdo de energia).
Ou seja,
durante a reacção química há mudança de energia.
Existem três possibilidades:
- os produtos contêm mais energia do que os reagentes
- os produtos contêm menos energia do que os reagentes
- os produtos contêm igual energia como os reagentes
No caso 1, os produtos ganharam energia, o que somente é possível quando o sistema das substâncias recebe energia de fora. (ΔH > 0). Foi uma reacção endotérmica.
No caso 2, os reagentes perdem energia, o que somente é possível quando o sistema das substâncias perde energia para fora (ΔH < 0). Foi uma reacção exotérmica.
No caso 3, trata-se dum sistema químico em equilíbrio (ΔH = 0).
Diagramas de energia
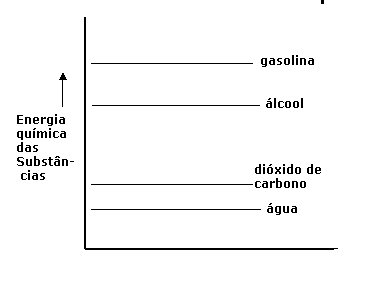
No caso de gasolina em reacção com Oxigénio (são duas substâncias com bastante energia interna) formam-se os produtos água e dióxido de carbono, duas substâncias com pouca energia interna. Claro que, durante esta reacção, houve perca de energia química ou energia interna, que não pode simplesmente desaparecer.
Aquela energia liberta-se de outra forma: calor na maioria das vezes. A diferença entre a energia química dos reagentes e produtos, é chamada ‘energia da reacção’, com o símbolo ∆H.
No caso de libertação de energia, ∆H apanha um valor negativa (o sistema perde energia e a reacção é exotérmica).
No caso de necessidade de energia, ∆H tem sinal positivo: o sistema ganha energia e a reacção é endotérmica.
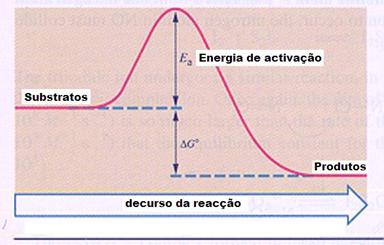
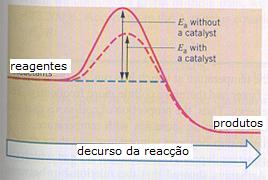
reagentes formam produtos, seja sem ou com catalisador.
ΔGo apresenta a energia da reacção e muitas vezes usamos o símbolo ΔH.
Ea é a energia de activação.
Exercício 24
A condensação do vapor de água, será um processo exotérmico o endotérmico?
Explique.
resposta 07-24
Exercício 25
Elabore um diagrama da energia da reacção 'combustão de gasolina'.
De certa maneira podemos afirmar que há substâncias fracas (aqueles com pouca reactividade) e substâncias fortes (com muita reactividade). É uma maneira de dizer muito aplicada na química.
Um resumo:
Exotérmica é a reacção na qual os produtos contêm menos energia interna (química) do que os reagentes.
Endotérmica é a reacção na qual os reagentes contêm menos energia interna do que os produtos.
voltar ao curso


