6.4 Fórmula tampão
Exercício 69:
Primeiro calcular o pH de 1M ácido acético; depois calcular o pH de uma mistura de 1M ácido acético + 1M acetato de sódio.
Uma solução tampão tem a tarefa de manter o mais estável possível o pH duma solução, mesmo em casos de juntar ácido ou base forte.
Numa solução tampão juntamos, mais ou menos em quantidades iguais, ácido (fraco) HA e base fraca e conjugada (A-); a última substância podemos juntar de forma NaA (bem solúvel). O HA tem como função compensar a adição de base e o A- deve compensar ácido juntado.
Quanto mais ácido fraco en base conjugada são juntados, mais ácido ou base forte podem compensados, ou seja, maior é a capacidade tampão.
SOLUÇÃO TAMPÃO:
Uma mistura bastante concentrada dum ácido fraco com uma base conjugado fraco
Numa solução dum ácido fraco sempre está em vigor:
[H3O+] = [A-] (os dois formam-se em quantidades iguais de HA).
Numa solução tampão, todavia, existe muito mais A- (foi juntado atravez do sal). Assim, numa solução tampão as duas concentrações já não são iguais.
- Juntando um pouco de ácido forte com uma solução tampão, é compensado pelo base A-.
Exercício 70:
Elabore a equação da reacção em juntar um pouco de ião hidrónio (oxónio). (A [HA] aumenta um bocadinho; a [Z-] diminui um pouxo).
- Juntando um pouco de base forte com uma solução tampão, é compensado pelo ácido HA
Exercício71:
Anote a reacção, quando juntamos um pouco OH- e explique o que muda nas quantidades de Ha e A-.
Tentamos deduzir da fórmula bem conhecida de KA a fórmula tampão:
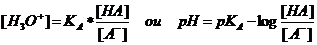
Exercício 72:
Responder as seguintes três perguntas:
- Uma mistura ácido clorídrico e sal da cosinhna será uma solução tampão? Explique.
- Qual o pH da mistura de 1 mol oxalato de sódio em 2 litros de água?
- Qual o pH da mistura de u mol oxalato de sódio + 1 mol hidrogénio-oxalato de sódio em 2 litros de água?
voltar ao curso