Reacções redox típicas na química orgânica
A descrição das reacções redox encontra-se no módulo 10 onde surgiu a definição da mudança do número de oxidação.
Reacções redox acontecem muito na química do carbono e nem sempre é fácil descrever exactamente a transferência dos electrões.
Também não disponibilizamos de tabelas redox que mostram todas as semi-reacções.
Portanto, neste ramo da química, é melhor investigar as mudanças do Nox. Uma das mudanças sempre é um dos átomos de carbono, quer oxidante quer redutor.
Exemplo
Consideramos metanol:
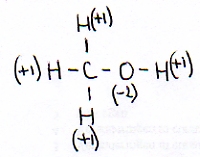 De modo geral podemos afirmar que:
De modo geral podemos afirmar que:
- o Nox de H nas substâncias é e fica +1
- o Nox de O nas substâncias é e fica -2
- na substância metanol existem três ligações C - H, uma ligação O - H e uma ligação C - O .
- o Carbono deve ter o Nox = -2 [controlar por favor]
Exercício 26
Calcular o número de oxidação dos átomos de carbono nas seguintes substâncias:
| Etano |
etanol |
etanal |
etoxietano |
etiletanoato |
metano |
resposta 11-26
Oxidar uma cadeia apolar é bastante difícil. Uma distribuição bem equilibrada dos electrões de valência cria apenas diferenças pequenas nas electronegatividades.
A presença de cargas δ+ e δ- causa ataques electrófilos ou nucleófilos.
Assim, a cadeia de carbono que já contém um átomo de oxigénio pode sofrer oxidação, mais ou menos facilmente. O átomo de oxigénio, ou outros átomos com grande electronegatividade, causa uma boa polaridade na própria substância.
Temos que considerar o facto que ataques exigem uma polaridade, mas também um lugar onde mais oxigénio pode ligar.
Portanto, regra geral ou condição prática para este tipo de oxidação de um átomo C é a presença duma ligação do próprio carbono com um átomo de hidrogénio + uma ligação C - O do mesmo carbono.
O oxidante O toma posição entre o C e o H.
Alcanos

 Oxidar alcanos não é tão fácil. Todas as ligações dos alcanos são apolares com pouca afecção para oxidantes.
Oxidar alcanos não é tão fácil. Todas as ligações dos alcanos são apolares com pouca afecção para oxidantes.
Oxidar alcanos acontece em particular com oxigénio da atmosfera: combustão directa ou indirecta, por exemplo a combustão de gás natural com os produtos água e óxidos de carbono.
Exercício 27
Cumbustão completa de gás natural vem com mudanças de números de oxidação.
Mostre estas mudanças.
Álcoois

Combustão directa dum álcool também é possível, mas aqui existe a outra maneira com oxidantes mais fracas e com produtos especiais.
Por exemplo, o ião dicromato no meio ácido pode oxidar o alcanol primário formando o produto 'ácido' via o intermediar alcanal.
Exercício 28
As seguintes substâncias podem ser oxidadas com dicromato, sim ou não?
Caso sim, qual é o produto?
Explique a sua resposta.
- 2-propanol
- Etadiol (glicol)
Exercício 29
Afirmação: 2-metil 2-propanol pode ser oxidado com iões de permanganato.
A afirmação é sim ou não verdadeira?
Explique a sua resposta.
Exercício 30
Durante a oxidação de 1-propanol com permanganato(aq) na presença de ácido sulfúrico, o propanol muda para propanal.
- Dá as fórmulas electrónicas das duas substâncias orgânicas e compare o número presente dos electrões de valência.
- Também dá as duas semi-reacções em fórmulas moleculares.
N.B.
Na oxidação dum álcool (alcanol), a primeira passe é a formação dum átomo C com dois grupos OH (controle!).
Já sabes que uma tal situação não fica estável; dos dois grupos OH afasta-se uma molécula de água, deixando o C com uma dupla ligação com O (alcanal, alcanono, ácido carboxílico).
Alcanais


Para oxidar alcanois usamos muitas vezes permanganto ou dicromato acidulado; i.é, com um oxidante bastante forte.
Para oxidar alcanais, tais oxidantes fortes não são necessários.
O alcanal contem um grupo aldeido (-CHO). A ligação C=O é bastante polar e oxidantes conseguem facilmente atacar a parte δ+ do carbono (em busca de electrões).
Oxidantes fracos, como iões de prata ou cobre(II) já podem oxidar os alcanais, o produto sendo um ácido (grupo carboxílico).
Portanto, é mais fácil oxidar um alcanal do que um alcanol.
Exercício 31
- Qual será o produto da oxidação de etanal?
- Idem para metanal (n.b.: aqui temos uma situação extraordinária!!)
Alcanonos

No caso de alcanonos, existe uma boa electronegatividade entre C e O, mas falta uma ligação C - H para receber mais O.
Será mais difícil oxidar alcananonos sem quebrar ligações C — C .
Exercício 32
Afirmações:
- O alcanono contem um grupo polar
- O alcanono não pode ser oxidado facilmente
São verdadeiras estas afirmações, sim ou não? Explique.
ácidos alcanóicos
Exercício 33
Afirmações:
- O ácido metanóico pode ser oxidado facilmente
- O ácido etanóico pode ser oxidado facilmente
São verdadeiras estas afirmações, sim ou não? Explique.
Resposta 11-33
Exercício 34
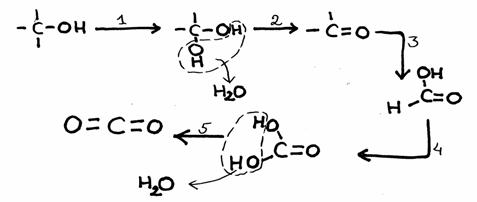
Estude bem o esquema de reacções em baixo, com 5 passos.
De cada passo, indique se seja sim ou não uma reacção redox.
Caso sim, dá um possível oxidante.
Para lembrar:
- nestes casos, uma oxidação vem com a introdução dum átomo O dentro de C e H.
- nas substâncias orgânicas, de modo geral é instável a presença de dois grupos OH ao mesmo C.
- os produtos finais aqui são dióxido de carbono e água.
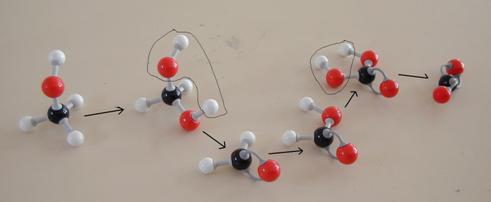
As mesmas reacções em modelos:
Exercício 35
Carbeto de cálcio (C2H2) é uma substância branca e sólida com cheiro específico, muito instável, reage espontaneamente com água.
Os produtos desta reacção: um gás com cheiro picante e uma solução básica. Quando o gás passa uma solução aquosa de Bromo, a cor amarela desaparece.
Explique o que acontece durante a formação do gás, usando fórmulas estruturais. Será que isto é uma reacção redox?
Resposta 11-35
éteres
É verdade que aqui encontramos um O ligado a átomos de carbono, só que neste caso isto não resulta em grande polaridade.
Podemos ver uma certa simetria na molécula, que por isto fica com pouca polaridade. Será difícil oxidar éteres.
Exercício 36
Explique a eventual possibilidade de oxidação com dicromato acidulado de:
- Butano
- 2-metil propanol-2
- acetono
- metoximetano
ácidos carboxílicos
É difícil oxidar ácidos orgânicos. Não falta polaridade, mas sim falta mais um lugar ao Cδ+ onde mais Oxigénio queria ligar.
A mesma podemos afirmar acerca dos ésteres.
Uma ligação entre dois átomos de carbono (C - C) podemos oxidar muito dificilmente. A ligação é forte demais.
Só numa combustão completa ou com oxidantes extremamente fortes (como ácido sulfúrico concentrado e quente) isto será possível.
Exercício 37
Ácido metanóico e di-ácido carbónico podem ser oxidados facilmente.
Explique porque é que estes ácidos 'ácido fórmico' e 'ácido oxálico' são exepções na regra geral.
No caso de ácido oxálico, mostre as fórmulas electrónicas do reagente e do produto e explique as diferenças.
voltar ao curso
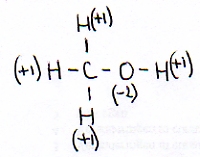 De modo geral podemos afirmar que:
De modo geral podemos afirmar que:

 Oxidar alcanos não é tão fácil. Todas as ligações dos alcanos são apolares com pouca afecção para oxidantes.
Oxidar alcanos não é tão fácil. Todas as ligações dos alcanos são apolares com pouca afecção para oxidantes.






