Regulação da actividade enzimática:
Reacções não catalisadas, que podem requerer horas de fervura na presença de um ácido ou de uma base forte, podem ocorrer em fracções de segundo, na presença da enzima apropriada, à temperatura ambiente e em pH muito próximo do neutro.
As enzimas actuam como catalisadores, diminuindo enormamente a energia de activação das reacções bioquímicas específicas.
A energia de activação diminuída permite que estas reacções se processem em altas velocidades, à temperatura do corpo.
Existem várias maneiras de regulação da actividade enzimática:
Varias enzimas nem sempre estão disponíveis / prontas para funcionar, mas sim encontram-se no estado de 'pro-enzima' ou zimogénio. Razões para tal são: a protecção duma enzima vulnerável ou somente necessário no caso de acidentes.
Assim, no estômago, existe o pepsinogénio que pode formar a enzima pepsina a valores baixos de pH. Uma vez formada, a pepsina não pode voltar. O pepsinogénio perda uma cadeia de 44 aminoácidos.
O próprio produto pode (em concentrações altas e dentro da reacção em equilíbrio) voltar, assim proibindo a enzima a continuar sua acção.
Conhecendo a enzima, é possível elaborar substâncias que podem - especificamente - influenciar a acção da enzima (inibidores, moléculas com estruturas comparáveis com o substrato normal, mas não igual), assim impossibilitando a enzima na sua acção regular. Estas drogas usam-se - por exemplo - na quimioterapia para proibir o metabolismo de tumores.
Certas enzimas têm, além do centro activo, um outro sítio onde possam ligar certos grupos; são centros alostéricos. Substâncias que cabem neste centro alostérico podem mudar a forma tridimensional da enzima, incluindo o centro activo, e assim mudar a especificidade ou a actividade. Pode ser uma influência positiva (mais actividade) ou negativo.
Exercício 39
As seguintes afirmações são verdadeiras, sim ou não? Explique a sua resposta.
- A enzima é um (bio)catalisador que influencia a velocidade da reacção.
- Um catalisador acelera (ou reduz) a velocidade V duma reacção química: S
 P
P
- Explique as letras S, P e V nas suas próprias palavras a um colega.
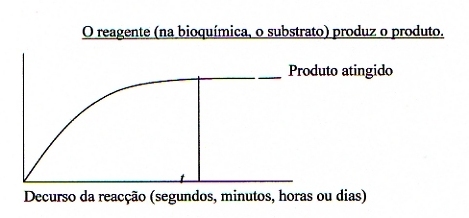
De modo geral, as reacções bioquímicas são reacções em equilíbrio. Isto implica que a formação do produto chega ao seu máximo depois de algum tempo (t), logo que o equilíbrio se estabeleceu. Sem catalisador, essas reacções são muito lentas; t pode chegar a valores de horas ou dias. A presença do catalisador não aumenta a concentração do produto no equilíbrio, mas sim o tempo necessário para atingir esta concentração. Em vez de dias ou horas, o produto forma-se dentro de segundos (que muda o gráfico).
O biocatalisador - normalmente - acelera o processo químico com factores de 106 ou mais.
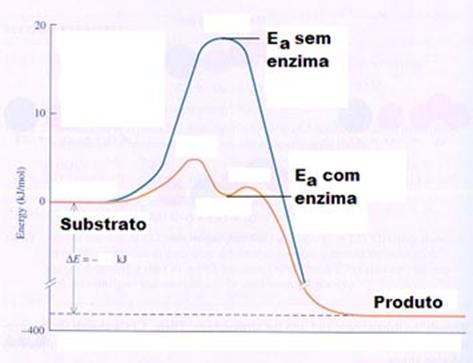
Decurso da reacção 
O substrato forma um complexo com a enzima. Este complexo é chamado 'o estado de transição.
Depois a enzima e o produto separam-se uma do outro.
S + E
 ES
ES
 P + E
P + E
a b
A formação do complexo (a) é ema reacção em equilíbrio a; a última reacção b não é. A enzima acelera a obtenção do equilíbrio (não muda o próprio equilíbrio) e acelera a
formação do produto.
voltar ao curso

