Additie
In een koolstofketen kun je dubbele of drievoudige bindingen hebben tussen de C-atomen. In dat geval wordt de stof "onverzadigd" genoemd, d.w.z. die dubbele bindingen kunnen opengaan en aan weerskanten atomen opnemen.
Zo'n binding gaat dan open (op een of andere manier) en de C-atomen aan beide kanten krijgen een open plek, een ongepaard elektron. Een ander atoom dat daarvoor geschikt is, kan dan die opengevallen plaats innemen.
Let wel, we hebben het niet over substitutie waarbij een atoom wordt vervangen, maar over additie waarbij een nieuwe binding wordt gemaakt met zo'n C-atoom.
Stel je het maar als volgt voor: twee mensen houden elkaar handen vast. Ze laten één hand los en pakken de hand van iemand anders.
Met modellen kun je dit reactietype demonstreren, bijvoorbeeld etheen met chloor.
Daarbij kun je ontdekken dat de binding tussen de C-atomen hun rotatieflexibiliteit behouden of juist verliezen.
Additie is dus de reactie van een onverzadigde stof die zich verzadigd met nieuw aangekoppelde atomen of atoomgroepen.
We kunnen het verschijnsel additie ook benaderen vanuit de zogenaamde π en σ-bindingen.
Die bestaan in één molecuul als de koolstofketen dubbele of drievoudige bindingen heeft.
Je kunt ook zeggen: er is overlapping van hybride-orbitalen van het type sp2 en/of sp. De beide bindingstypes σ (lineaire overlapping) en π (parallelle overlapping). Alleen de π-bindingen nemen deel aan de additie.
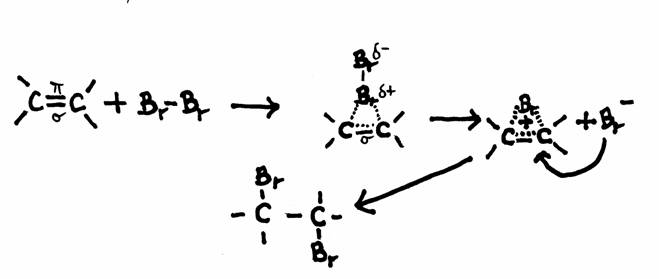
voorbeeld van een mogelijk mechanisme van additie: Broom en Etheen
Etheen heeft een dubbele binding, dus een plaats met hogere elektronendichtheid (vier elektronen) en dus met hogere concentratie van negatieve lading.
Die negatieve lading wordt met name veroorzaakt door de π-elektronen.
Als een broommolecuul deze binding nadert veroorzaakt dat in het broommolecuul een soort polaire inductie en vormt zich, laten we zeggen, een additiebrug.
Een ander broomatoom kan deze brug nu van de andere kant benaderen zoals te zien in de tekening.
Alkenen kunnen additie ondergaan met diverse stoffen, zoals:
Broom en de overige halogenen; Waterstof; Water; en meer.
Let op: meestal is voor een goede additie een katalysator nodig.
Etheengas (acetyleen) dat bij de reactie van water met carbied, is een zeer energierijke stof.
Vroeger werd die gebruikt in lampen (carbietlantaarns). Tegenwoordig vooral bij lassen.
Ethyngas is zeer toegankelijk voor additie; in feite kan twee keer additie optreden.
