Chromatografie, drie soorten
- Papierchromatografie
- Kolomchromatografie
- Gaschromatografie
Chromatografie (zie ook wikipedia) wordt heel vaak toegepast in de chemische laboratoria:
Papierchromatografie
Een mengsel (dus met verschillende deeltjes) passeert een vaste laag (papier, gel van aluminiumoxide, of andere poreuze stoffen)
De verschillende deeltjes van het opgeloste mengsel worden meer of minder sterk geabsorbeerd door die vaste laag (afhankelijk van, bijvoorbeeld, polaire eigenschappen).
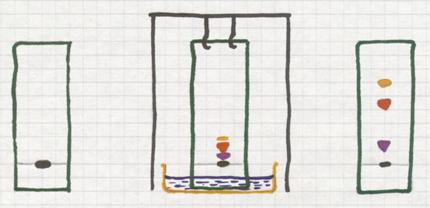
Plaats op een stukje filtreerpapier een klein stipje zwarte inkt (dat is zeker een mengsel van diverse kleurstoffen).
Kies een 'loopvloeistof' waar je het papier met de onderkant in hangt. Door de capillaire werking trekt die vloeistof naar boven, passeert het inktvlekje. Op dat moment neemt die vloeistof de componenten met verschillende snelheden mee naar boven.
Zo zal de slechtst oplosbare component vrijwel op zijn plaats blijven, niet naar boven mee trekken. Maar een component die redelijk oplost in die loopvloeistof, die zal meetrekken naar boven. Zo haal je de componenten uit elkaar en zie je aan het eind enkele vlekjes met diverse kleuren.
Kolomchromatografie
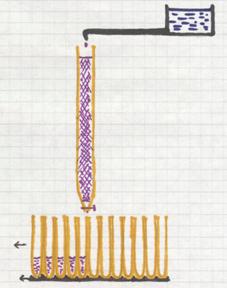
Een speciaal type van chromatografie is de kolomchromatografie. De kolom (een glazen buis) is vol met een speciale vaste stof (zand, aluminiumoxide, bepaalde gel, e.a.). Bovenop wordt een mengsel van componenten aangebracht; dat laat je in de kolom trekken en meteen open je een kraantje dat druppelsgewijs een "loopvloeistof" laat doorsijpelen. Tijdens dat doorsijpelen wordt het mengsel meegenomen naar beneden, maar wel elke component van het mengsel met zijn eigen snelheid.
Die snelheid hangt namelijk af van factoren als: hoe groot zijn de deeltjes van die component? Hoe oplosbaar is de component in de loopvloeistof? hoe goed wordt de component geabsorbeerd aan de vaste stof? enzovoort.
Om de zoveel seconden wordt er een nieuwe reageerbuis onder de kolom gezet om de vloeistof op te vangen. Aan het eind van dit proces bevat elke reageerbuis een klein beetje loopvloeistof + in sommige buizen een beetje component. Er zijn prima detectiemethoden om te kijken waar dat zit.
Gaschromatografie
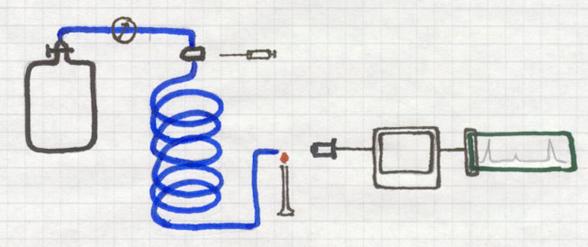
Ook gaschromatografie is een methode die absorptie toepast.
Stoffen worden geabsorbeerd door een 'drager'.
Een lange, dunne, spiraalvormig gebogen buis bevat een poreuze vaste stof, de drager. Continu passeert een (inert) gas door die buis, dus langs die drager. Het gas (zou bijvoorbeeld He kunnen zijn) is afkomstig van een cilinder waar de gasdruk heel precies wordt bijgehouden. Helium wordt er wel voor gebruikt, maar ook andere inerte (niet reagerende) gassen.
Aan het begin van de buis bevindt zich een injectiekamertje waar je een gas(mengsel) kan inspuiten. Dat onbekende gasmengsel wil je gaan onderzoeken. De ingespoten, kleine hoeveelheid daarvan wordt meteen meegenomen door het draaggas door de buis heen. De ene component zal sneller door de buis kunnen dan de ander, afhankelijk van de absorptie door de drager. Dus zal het ene gas eerder de buis verlaten dan het andere.
Aan het uiteinde kan bijvoorbeeld een microvlam staan die met een kleurverandering reageert op het naar buiten komen van een component. Een detector analiseert dan de kleur en de intensiteit van dat gas, of van de verbrandingsproducten, en zet dat om in een signaal dat geprint kan worden.
Zo kun je niet alleen bepalen welke componenten in het mengsel zaten, maar ook in welk percentage.
Eťn van de scheidingsmechanismen van deeltjes, in kolommen, is gebaseerd op het verschil in grootte van de deeltjes.
De vraag is nu welke deeltjes de kolom het eerst zullen verlaten: de grootste of de kleinste.
Misschien verwacht je dat niet, maar de grootste zullen het snelst door de kolom lopen. De reden zit in het feit dat de kleinere deeltjes langer worden opgehouden; die kunnen zich namelijk ook in de kleinere poriŽn begeven, en zo langer onderweg zijn.
net weer even andere benadering van de chromatografie
Chromatografie is een analysemethode, die vaak ook gebruikt wordt om mengsels te scheiden; je kunt er dus mee onderzoeken welke stof je hebt, en bovendien kun je er de verschillende componenten mee uit elkaar halen.
Als je met een viltstift een lijn trekt op een stuk filtreerpapier en vervolgens laat je een vloeistof in dat papier trekken vanaf ť ťn kant, dan zul je zien dat die lijn een eind met die vloeistof meeloopt en ook dat de inkt samengesteld was uit meerdere kleurcomponenten. De ene kleur loopt harder met de vloeistof mee dan de andere.
Elke kleurcomponent moet voortdurend kiezen of ze in op dezelfde plaats in het papier zal blijven zitten of dat ze met de bewegende vloeistof mee zal trekken. Dat laatste noemt men wel de "affiniteit van de component tot de twee fasen.
In dit geval heb je twee fasen:
- het papier is de vaste fase
- de vloeistof is de mobiele fase
Als een bepaalde kleurstof dus een grote affiniteit heeft voor de mobiele fase, dan verplaatst die kleurstof zich over een grote afstand; die komt het verst.
Definitie
Chromatografie is een scheidingsmethode die berust op (het verschil in) de affiniteit van de te onderzoeken stof(fen) ten opzichte van twee fasen, een bewegende en een vaste fase.
De naam chromatografie is afkomstig van het feit, dat deze methode aanvankelijk alleen werd gebruikt voor het scheiden van kleurstoffen, die via extraktie uit planten werden gehaald.
Tegenwoordig zijn er heel wat technieken om ook kleurloze stoffen terug te vinden, maar de naam chromatografie is toch gehandhaafd.
Behalve kleurstoffen kan men ook onderzoeken en scheiden:
- organische en anorganische moleculen
- vele soorten ionen
- biologisch actieve stoffen, zoals: eiwitten, nucleÔnezuren en virussen.
Bij chromatografie is er dus sprake van twee fasen. Een van die fasen is de stationaire of vaste fase, dus op zijn plaats blijft. De andere fase, de mobiele of bewegende fase, beweegt zich langs die stationaire fase; er is een intensief kontakt tussen beide fasen. De te onderzoeken stof(fen) zijn van te voren ergens op de stationaire fase aangebracht en moeten zich over de beide fasen gaan verdelen als de mobiele fase langs komt.
De stationaire fase kan (s) of (l) zijn.
De mobiele fase kan (l) of (g) zijn.
Zo kun je vier chromatografische technieken onderscheiden:
|
vaste
fase |
(s) |
(l) |
mobile
fase |
|
|
|
(l) |
|
(s) + (l) |
(l) + (l) |
(g) |
|
(s) + (g) |
(l) + (g) |
Als de stationaire fase (l) is, dan is er een zgn. drager nodig.
Een ander onderscheid dat je in de chromatografie kunt maken berust of de uitvoeringstechniek.
Twee technieken moet je in elk geval kennen:
- dunnelaagchromatografie
De boven beschreven scheiding van kleurstoffen in een vel filtreerpapier behoort tot de dunnelaagchromatografie. Het papier is dan de stationaire fase (of bevat de stationaire fase). Een andere mogelijkheid is dat een dunne laag vaste stof (de stationaire fase) vast gezet wordt op een stevige aluminiumfolie. De mobiele fase is hier altijd (l) die door de poriŽn van de stationaire fase zich verplaatst (door diffusie).
- kolomchromatografie
Bij kolomchromatografie vult men een glazen buis (dik of dun) met een stationaire fase; bovenin wordt de mobiele fase (l) of (g) ingeleid en onderaan die buis ontsnapt die mobiele fase.
Een voordeel van deze methode is dat de doorstroomsnelheid van de mobiele fase zeer goed te regelen is ťn dat m.b.v. een detektor onder aan de buis direkt kan worden opgemerkt of er een stof doorkomt en zelfs hoe veel.
Een ander en zeer veel toegepaste methode van kolomchromatografie is de GASCHROMATOGRAFIE. Een draaggas (inert of edel) beweegt zich door een lange poreuze kolom en neemt met verschillende snelheden een ingebracht gasmengsel met zich mee.


