Condensatie & Hydrolyse
Condensatie en Hydrolyse zijn elkaars tegengestelde, elkaars omgekeerde reactie.
Condensatie:
Twee moleculen verbinden zich tot één nieuw molecuul met water als bijproduct.
molecuul 1 + molecuul 2  nieuw molecuul + water
nieuw molecuul + water
Bijvoorbeeld de vorming van een ester:
ethanol + ethaanzuur  ethylethanaat + H2O
ethylethanaat + H2O
(een ouder woord voor ethylethanaat = ethylacetaat)
in structuurformules:
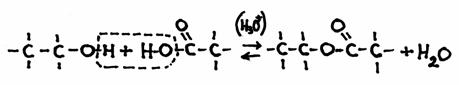
Het is een reversibel proces, dus de directe reactie is de condensatie en de terugreactie wordt hydrolyse genoemd.
Hydrolyse: Een molecuul reageert met water en vormt dan twee nieuwe moleculen
molecuul + watermolecuul  molecuul 1 + molecuul 2
molecuul 1 + molecuul 2
Bijvoorbeeld de splitsing van een ether in alkanolen.
ethoxi-propaan + water  Ethanol + propanol.
Ethanol + propanol.
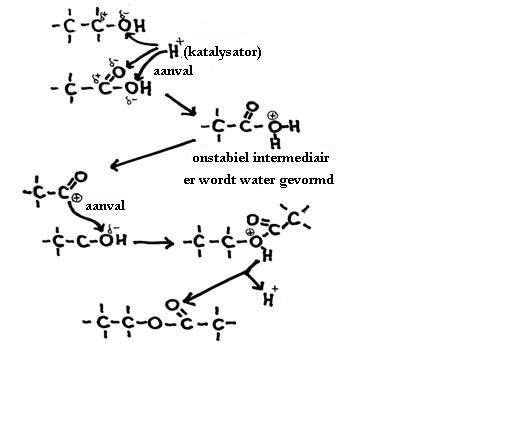
Bovengenoemde reacties kunnen worden versneld met een katalysator. Daarvoor kun je bijvoorbeeld een zuur nemen.
De H+-ionen vallen op een negatieve plek aan en in dat geval noemt men het mechanisme "elektrofyl".
Er zijn andere mechanismen waarin negatieve deeltjes aanvallen op positieve plekken van een of ander molecuul en dan noemen we dat "nucleofyl".
Het komt ook voor dat een alkanol reageert met een niet-organisch zuur. Zo kan bijvoorbeeld glycerol reageren met salpeterzuur.
Normaal reageert glycerol met vetzuren om vetten en oliën te vormen, maar de reactie met salpeterzuur is vergelijkbaar:
 nieuw molecuul + water
nieuw molecuul + water
 ethylethanaat + H2O
ethylethanaat + H2O
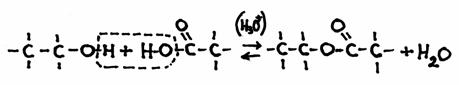

 molecuul 1 + molecuul 2
molecuul 1 + molecuul 2
 Ethanol + propanol.
Ethanol + propanol.