Werken met p-waarden en belangrijke constanten
In diverse modules is al gewerkt met logaritmen, negatieve logaritmen en p-waarden.
Het beste is om dat nu nog even op te halen door er mee te oefenen:
- log10-2 = -2 en ook:p10-2 = 2
- log 4.10-2 = log4 + log10-2 = -2 + log4 = -2 + 0,60= -1,40 en ook:p4.10-2 = p4 + p10-2 = 2-log4= 2-0,60 = 1,40
- pX = 3,7 = 4-0,3 = 4-log2,00 dus ook: X = 2.10-4
een aantal constanten in de scheikunde:
pH
De reden dat men veel met negatieve logaritmen (p-waarden) werkt ligt in het gegeven dat in de scheikunde de concentraties van stoffen zo klein is.
Als je er eenmaal aan gewend bent, zul je merken dat het veel eenvoudiger is om te schrijven:
pH = 6 i.p.v. [H3O+] = 10-6 mol/l
of:
pOH = 8 i.p.v. [OH-]= 10-8 mol/l
Altijd als je de concentraties opschrijft, moet je de eenheid mol/l er bij zetten. Als je met de p-waarde werkt hoeft dat niet.
Kw
(waterconstante)
In module 9 is al besproken dat water zelf een zwak amfolyt is, dus een zeer zwakke base én een zeer zwak zuur.
Als er in water geen andere stoffen zijn opgelost, dan is de pH van dat water bij 25 graden precies 7 en ook de pOH = 7.
Bij het waterevenwicht (H2O + H2O  H3O+ + OH-) behoort uiteraard ook een evenwichtsvoorwaaarde K:
H3O+ + OH-) behoort uiteraard ook een evenwichtsvoorwaaarde K:
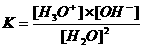
De waterconcentratie is constant.
Uit bovenstaande kan de volgende betrekking worden afgeleid:
K.[H2O]2 = [H3O+].[OH-]
 K·55,5 = Kw = 10-7·10-7 = 10-14
K·55,5 = Kw = 10-7·10-7 = 10-14
Kw noemt men de waterconstante en is bij 25°C : 10-14
Zoals alle evenwichtsconstanten is ook de waterconstante alleen afhankelijk van de temperatuur.
De bovenstaande formules kun je ook m.b.v. p-waarden opschrijven:
pKw = pH + pOH
of in getallen:
pKw = 14 = 7 + 7
Als de pH en de pOH aan elkaar gelijk zijn, dus de [H3O+] en de [OH-] zijn aan elkaar gelijk, dan is de oplossing neutraal.
Omdat Kw een constante is (dus pKw ook) moeten pH en pOH samen altijd 14 zijn
bijvoorbeeld: pH = 5 en pOH = 9. [let op: alleen bij kamertemperatuur!]
Als de pH groter wordt, dan wordt de pOH kleiner en v.v.
- Door toevoeging van zuur wordt de [H3O+] groter, dus de pH <.
- Door toevoeging van base wordt de [OH-] groter, dus de pOH <.
KA en KB
(zuur- en baseconstante)
Als een zuur(HZ of HA) of een base(Z- of A-) in water wordt opgelost, dan stelt zich een evenwicht in.
HZ is nederlands; HA is engels
Voor zowel het zuur als voor de base (in water) kan men dan een evenwichtsconstante opstellen:

Omdat de [H2O] constant is (nl. 55,5 mol/l), wordt deze concentratie ondergebracht bij de evenwichtsconstante K
Kz heet zuurconstante
Kb heet baseconstante
Een geconjugeerde base hoort bij een zuur dat één proton heeft afgestaan.
In tabel I staan geconjugeerde zuren en basen naast elkaar. Het verschil tussen links en rechts is steeds één proton.
Bij 25°C is het product van zuurconstante en baseconstante van de geconjugeerde stoffen altijd 10-14
Oplosbaarheidsproduct KS en oplosbaarheid S
In tabel XI kun je van een groot aantal stoffen opzoeken of ze oplossen in water (en in andere oplosmiddelen) en zo ja, hoeveel er dan maximaal kan oplossen; dus wanneer ze verzadigd zijn.
Voor alle stoffen, dus ook voor zouten, is er een verzadigingspunt.
Slecht oplosbare zouten bereiken dit punt zeer snel, goed oplosbare zouten bereiken dit verzadigingspunt pas veel later.
De oplosbaarheid van een zout wordt meestal aangegeven in de eenheid mol/liter, soms in mol/100 gr.
Als een zout in water (gedeeltelijk) oplost, dan valt het ionrooster (ook gedeeltelijk) uit elkaar; er ontstaan dan meer deeltjes.
Het oplossen is afhankelijk van de sterkte van het ionrooster, maar ook van de temperatuur. Bij hogere temperatuur valt meer ionrooster uit elkaar.
Slecht oplosbare zouten zijn zouten waarvan het ionrooster slechts voor een (zeer) klein gedeelte uit elkaar valt in water.
Er is dan sprake van een heterogeen en eenzijdig evenwicht.
Het kleine beetje zilvercarbonaat dat oplost in water(mol/l) heet de oplosbaarheid S bij een bepaalde temperatuur.
Let er op dat in dit voorbeeld uit S mol zilvercarbonaat dus gevormd worden: 2S mol zilverionen en S mol carbonaationen.
De ionen verspreiden zich homogeen door de hele oplossing.
Omdat het vaste en onopgeloste zilvercarbonaat heterogeen aanwezig is mag voor de concentratie daarvan in de evenwichtsvoorwaarde K de waarde 1 ingevuld worden.
Het ionenproduct (I.P.) in een verzadigde oplossing van een slecht oplosbaar zout noemt men het OPLOSBAARHEIDSPRODUCT KS
Je moet in staat zijn S te berekenen uit Ks en omgekeerd: Ks te berekenen uit S.