| CS2 (ΔE = ±0) | CO2 (ΔE = ±1.0) | H2O (ΔE = ±1.3) |
| Covalente bindingen | Covalente bindingen | Covalente bindingen |
| Niet polaire moleculen | Niet polaire moleculen | Polaire moleculen |
| Er is geen dipool | Er is geen dipool | Dipool |
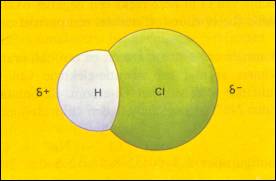
| Er zijn geen δ+ en δ- | Er zijn δ+ en δ- waarvan de zwaartepunten elkaar overlappen |
De zwaartepunten van δ+ en δ- overlappen elkaar niet (bevinden zich op afstand van elkaar) |
|
S=C=S
|
O = C = O
δ- δ+ δ- |
δ+
δ+
H H \ / O δ- |