Enzymregulatie
Niet gekatalyseerde reacties, die je bijvoorbeeld uren moet koken, zelfs al is er sterk zuur of base aanwezig, kunnen soms in een paar seconden bij fatsoenlijke temperatuur verlopen als het juiste enzym er bij zit, bij de optimale pH en temperatuur.
De enzymen treden op als katalysatoren door sterk de benodigde activeringsenergie te verlagen van deze specifieke biochemische reactie.
De verlaagde activeringsenergie staat toe dat zo'n proces dan verloopt op lichaamstemperatuur en met hoge snelheid
Er zijn diverse manieren om de enzymactiviteit te reguleren:
Verschillende enzymen staan niet meteen klaar om te functioneren, maar bevinden zich in een 'pre-enzym fase', of ook: de zymogene fase. Dit kan nodig zijn om het kwetsbare enzym te beschermen.
Het kan ook zijn dat het een enzym betreft dat pas nodig is in geval van ongelukken.
Zo hebben we in de maag pepsinogeen, dat het enzym pepsine kan vormen bij lage pH. Als het eenmaal is gevormd, kan het pepsine niet meer terug. Het pepsinogeen verliest een stuk keten van 44 aminozuren.
Het product zelf kan (als het hoge concentraties bereikt heeft) terugreageren en zo een enzym verbieden zijn activiteit voort te zetten.
Als het enzym bekend is kunnen specifieke stoffen worden toegevoegd die de enzymactiviteit beïnvloeden (remmers = moleculen met een structuur die lijkt op het normale substraat, maar toch niet helemaal gelijk is).
Zo maken die remmer het enzym (tijdelijk) inactief. Dus weer een vorm van regulering.
Eigenlijk hebben we het hier over drugs, geneesmiddelen die - bijvoorbeeld - gebruikt worden bij de chemotherapie door het metabolisme van tumoren te verbieden.
Sommige enzymen hebben naast een actiecentrum nóg een plek waar bepaalde groepen zich kunnen aanhechten: een zgn. allosterisch centrum.
Stoffen die in zo'n alosterisch centrum passen kunnen de driedimensionale vorm van het enzym wijzigen, inclusief het actiecentrum, en zo de specificiteit van dit enzym veranderen, en daarmee haar activiteit. Dat kan een positieve invloed zijn (actiever), maar ook een negatieve.
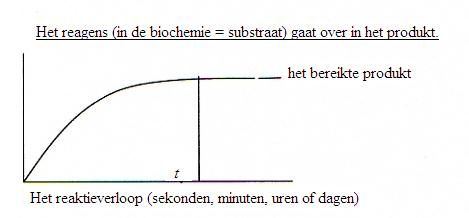
Meestal zijn biochemische reacties tevens evenwichtsreacties. Dat betekent dat de vorming van het product na enige tijd de maximum snelheid bereikt op het moment dat het evenwicht is bereikt.
Zonder katalysator (zie module 7) kan dat akelig lang duren: uren of zelfs dagen of helemaal nooit.
In aanwezigheid van een katalysator (een enzym) wordt dat evenwicht veel sneller bereikt. Dat wil dus niet zeggen dat je méér product krijgt, maar wel dat het sneller wordt gemaakt, mogelijk nu in een paar seconden.
Het enzym, de biokatalysator, versnelt meestal het chemisch proces met een factor 106 of meer.

Het substraat vormt een complex met een enzym. Dit complex wordt genoemd: de overgangstoestand. Het substraat verandert in product.
Vervolgens scheiden het product en het enzym zich van elkaar.
S + E  ES
ES  P + E
P + E
a b
De vorming van het complex (a)is ook een evenwichtsreactie; de laatste reactie (b) is dat niet.
Het enzym versnelt het bereiken van het evenwicht, maar verandert het evenwicht zelf niet. Wel de voming van het product.


 ES
ES  P + E
P + E