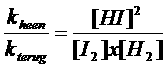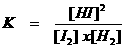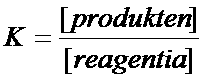Evenwichtsconstante
Vheen = kheen x [I2] x [H2]
en
Vterug = kterug x [HI]2
We weten dat bij evenwicht de heen- en de terugreactie even snel verlopen:
Vheen = Vterug
Oftewel:
kheen x [I2] x [H2] = kterug x [HI]2
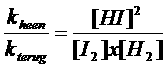
Let op: het quotiënt van de twee constantes geeft een nieuwe constante; we mogen dus schrijven:
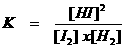
K noemen we: "de evenwichtsconstante"
K-waarden
Nogmaals: K is de evenwichtsconstante. Het is een quotiënt met boven de streep de concentraties van de producten en onder de streep de concentraties van de reagentia. Als die concentraties gelijk zijn, dan heeft K de waarde 1.
K=1 betekent dus dat er sprake is van een mooi evenwichtig evenwicht; gelijk aan beide kanten.
Heel veel evenwichten echter zijn helemaal niet zo mooi gelijk aan beide kanten. We zagen hiervoor al het voorbeeld van een slecht oplosbaar zout in water. Als er aan één kant van het evenwicht heel veel deeltjes zijn en aan de andere kant veel en veel minder, dan ligt het evenwicht eenzijdig, aan één kant. Dat is altijd de kant van de zwakkere stoffen, de stoffen die het moeilijkst reageren.
De waarde van K is dan heel groot of juist heel klein. Aan de waarde van K kun je dus meteen zal zien hoe de ligging van het evenwicht is.
Volgens afspraak wordt de "concentratie" van een vaste, heterogene stof de waarde 1 gegeven.
De waarde van K hangt niet af van veranderingen in concentraties, druk of van de aanwezigheid van een katalysator,
Die waarde verandert alleen als de temperatuur van het systeem in evenwicht verandert.
Er zijn veel evenwichten met extreem sterke stoffen aan één kant en heel zwakke stoffen aan de andere kant van de pijlen.
Nogmaals: als evenwicht bereikt is kunnen de concentraties aan beide kanten zeer verschillend zijn. Vrijwel zeker zal er heel veel zijn van de zwakke en heel weinig van de sterke stoffen.
Zo'n evenwicht ligt sterk aan één kant.
Dat zie je meteen aan de formule voor K en de waarde van K:
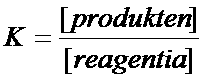
KC & KP
De evenwichtsconstante bevat alleen de concentraties van de stoffen die homogeen aanwezig zijn. In dit geval voeg je een C toe aan de K: KC .
Een andere homogene situatie is het geval van een gas-evenwicht. Dan spreken we niet zozeer van concentraties, maar wel van de (partiële) gasdruk van elk deelnemend gas. Elk gas in een gasmengsel draagt bij aan de druk.
De partiële druk van elke component is evenredig met de hoeveelheid van dat gas.
In de formule van de evenwichtsconstante vullen we hier de waarden in van die partiële drukken; de formule verandert niet in werkelijkheid, maar de K wordt soms aangegeven met KP.
- In homogene oplossingen gebruiken we KC
- Bij gassen gebruiken we KP