(s) (l) (g) (en (aq)
Bekijk op Youtube een klein filmpje.
Als we het hebben over fases, of aggregatietoestanden, behoort (aq) niet officiëel tot de fases.
Hieronder staat een schema dat de modellen van elke fase laat zien op deeltjesnivo.
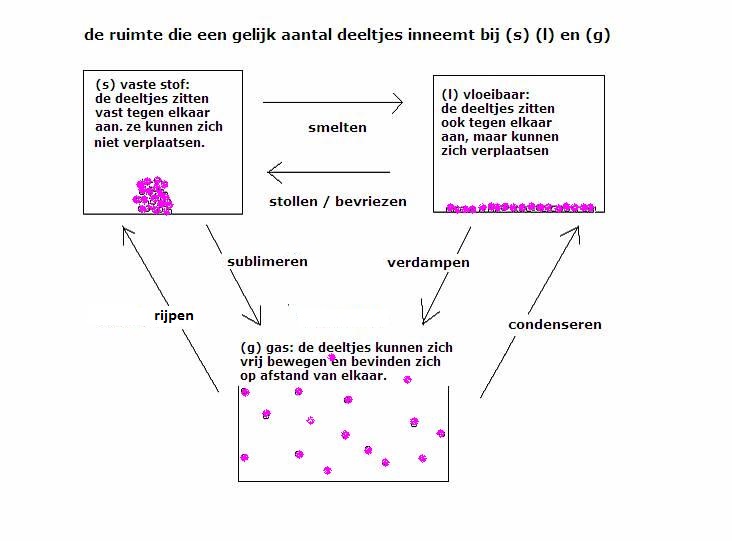
In vaste toestand bevinden de deeltjes zich op een vaste plek; ze kunnen zich niet verplaatsen. Wel zullen ze in trilling zijn, maar ze zijn niet mobiel. De trillingen zijn afhankelijk van de temperatuur. Als het vreselijk koud wordt, kunnen de trillingen helemaal ophouden.
Normaal vormen al die deeltjes tezamen een vast patroon, een rooster. In het groot zie je een kristalstructuur. Er zijn ook vaste stoffen zonder kristalstructuur: dat heet amorf. Voorbeelden hiervan zijn: glas, plastic en gel.
In de vloeibare fase hebben de deeltjes een zekere beweeglijkheid, ze kunnen zich verplaatsen, ze draaien wat om elkaar heen. Net als alle deeltjes, hebben ze ook nog een trillingsbeweging. Trillend rollen ze van de één naar de ander. De verplaatsing en de trilling zijn afhankelijk van het karakter van die deeltjes (bijvoorbeeld: zijn ze groot of klein) en van hun temperatuur (kinetische energie).
De deeltjes in een vloeistof vormen dus geen starre structuren, maar blijven ongeveer net zo dicht bijeen als in een vaste stof dankzij de onderlinge aantrekking. Het is een misverstand is om te denken dat een vloeistof precies zit tussen vast en gas. Vloeistoffen en vaste stoffen hebben een vergelijkbare dichtheid. Het feit dat de deeltjes zich kunnen verplaatsen, om elkaar heen kunnen draaien, veroorzaakt het vloeibare karakter.
In de gasfase zijn de deeltjes helemaal van elkaar gescheiden, ze bewegen zich afzonderlijk, ze hebben alle vrijheid daarvoor, afhankelijk weer van het karakter van de deeltjes en van de temperatuur.
Regelmatig zullen de gasdeeltjes onderling botsen (of ze botsen tegen de wand van de gashouder) en zo hun bewegingsrichting veranderen. Als ze niet genoeg energie (meer) hebben, bijvoorbeeld bij afkoeling, dan kan een botsing uitlopen op het bij elkaar blijven van de deeltjes → ze worden vloeistof of vaste stof.
N.B. Over vloeistoffen bestaat, zoals gezegd, een misconceptie (een onjuist idee):
In een vloeistof - net als in een vaste stof - blijven de deeltjes zeer dicht bij elkaar.
Het verschil met een vaste stof is dat de deeltjes niet vast zitten in een rooster, maar vrij langs elkaar kunnen bewegen; ze hebben kinetische energie genoeg daarvoor. Je kunt ook zeggen: de onderlinge aantrekkingskracht is niet genoeg voor het vormen van een rooster.
Als er energie wordt weggehaald, zoals bij afkoelen, dan gaan ze alsnog in een rooster zitten. Bij verhitting, dus als de deeltjes in een vloeistof meer energie krijgen kan het gebeuren dat ze zich van elkaar gaan verwijderen (naar gasfase).
In een vloeistof zitten de deeltjes dus zo dicht bij elkaar dat er geen mogelijkheid is (zoals bij gassen) om de stof samen te drukken.
(aq) gebruiken we heel vaak in de scheikunde, maar is geen fase. Het duidt op een mengsel waarbij een stof is opgelost in water.
NaCl(aq) wil dus zeggen: een oplossing van keukenzout in water.
