Gasvolume
Er is een fundamenteel verschil tussen gassen enerzijds en vaste stoffen en vloeistoffen anderzijds: Het eigenaardige van gassen is dat alle gasdeeltjes los zijn van elkaar, zich op afstand van elkaar bevinden. Daarom hangt het volume van een gas niet af van de grootte van de gasmoleculen.
Het gaat er maar om hoe ver al die moleculen van elkaar af zitten. Hoe groot is de onderlinge afstand tussen die moleculen? Daar gaat het om.
Bij vaste stoffen en vloeistoffen zitten of bewegen alle moleculen tegen elkaar aan. Dus bij (s) of (l) gaat het wel om de vraag: hoe groot zijn die moleculen? hoe groter, hoe meer volume ze innemen. Maar zo is het dus niet bij gassen!!
Het volume van een gas, dus eigenlijk de onderlinge afstand tussen de gasmoleculen, wordt dan ook in de eerste plaats en vrijwel uitsluitend bepaald door druk en temperatuur:
- Bij hogere druk zitten de gasmoleculen dichter op elkaar en is de onderlinge afstand kleiner en krijg je méér moleculen per liter en dus ook meer mol per liter. Ook wordt daardoor het gas zwaarder.
- Bij hogere temperatuur (d.w.z. de deeltjes bewegen dan feller) gaan de gasmoleculen wat verder uit elkaar zitten. Je krijgt zo minder moleculen gas per liter en dus minder mol/l. Een liter warm gas is ook lichter dan een liter koud gas.
Bij 0°C en 1 atm.druk is het volume van 1 mol gas 22,4 liter ongeacht welk gas het is. Bij een andere temperatuur en druk is dat volume anders, maar wel voor elk gas weer hetzelfde (dus: bij 100°C heeft elk gas een volume van bijv. 27 liter).
M.b.v. de algemene gaswet kun je berekenen hoeveel liter een mol gas is bij bepaalde temperatuur en druk. We hebben daarvoor een wiskundige formule.
Als je van twee gassen een gelijk volume neemt bij gelijke temperatuur en druk, dan bevinden zich daarin een gelijk aantal mol en een gelijk aantal moleculen, welk gas je ook neemt (zie fig).
We kijken naar het volume van 1 MOL gas. Dat is bij gassen bijzonder. (dus alleen (g), niet (s) of (l))
Een willekeurig gas bij de temperatuur van 0oC en een druk van 1 atm. heeft een volume van 22,4 liter per MOL (= molair volume van gassen).
N.B. Elk gas heeft dus eenzelfde molair volume, maar let op: niet dezelfde molaire massa!! De gasdeeltjes kunnen zwaarder of lichter zijn.
Het doet er niet toe over welk gas het gaat, het volume dat het bezet wordt altijd en uitsluitend bepaald door de temperatuur en de druk van dat gas, of dat gas nu grote of kleine moleculen heeft.
We passen dit toe met de volgende formule:
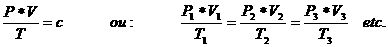
De temperatuur T wordt gegeven in Kelvin!! De druk in Nm2. Het volume in m3
De constante c is: n x R, waarbij:
n = het aantal mol en R = 0,0821 J x mol-1 x K-1