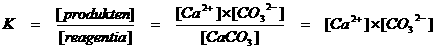Homogene en heterogene evenwichten
Stel dat alle stoffen die meedoen aan een evenwicht homogene stoffen zijn, dan noemen we ook het evenwicht een homogeen evenwicht. Elke stof die meedoet heeft een of andere concentratie (in geval van oplossingen en vloeistoffen) of druk (in geval van gassen).
Het volgende evenwicht is heterogeen: CaCO3(s)  CO2(g) + CaO(s)
CO2(g) + CaO(s)
Stel je een gesloten reactievat voor met een bepaalde hoeveelheid calciumcarbonaat op de bodem. Dat wordt flink verhit totdat het calciumcarbonaat gaat ontleden. Daarbij vormen zich het gas kooldioxide en ongebluste kalk (CaO).
In het reactievat (onder de zuiger) heerst een chemisch evenwicht tussen de twee vaste stoffen (heterogeen op de bodem) en het gas (homogeen verspreid door de ruimte in het vat). De enige stof met een concentratie dan wel druk is hier het gas kooldioxide.
Vaste stoffen krijgen in de vergelijking, in de formule voor de evenwichtsconstante de waarde 1. Dat is zo afgesproken voor heterogene stoffen.
Een ander voorbeeld van een heterogeen evenwicht is de dissociatie van een onoplosbaar zout in water.
Het woord "onoplosbaar" is niet exact, want er zullen toch altijd wat ionen aan het rooster ontsnappen als het zout in water is. De ontsnapte ionen (de producten) reageren graag terug om het zout te vormen.
Het volgende evenwicht stelt zich in:
CaCO3(s)  Ca2+(aq) + CO32-(aq)
Ca2+(aq) + CO32-(aq)
Van de vier componenten in dit mengsel is één het oplosmiddel en drie doen mee aan de eigenlijke reactie.
Alleen de ionen hebben een concentratie die ingevuld kan worden in de evenwichtsconstante:
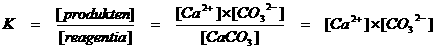
 CO2(g) + CaO(s)
CO2(g) + CaO(s)
 Ca2+(aq) + CO32-(aq)
Ca2+(aq) + CO32-(aq)