Reactiemechanisme
(botsingen van deeltjes)
Elke reactie heeft een reactiemechanisme: De opeenvolging van verschillende reactiestappen.
Bij de stappen vormen zich tussenproducten. Als er meerdere stappen zijn, hangt de totaalsnelheid af van de langzaamste stap.
Er bestaan chemische reacties waarbij de deeltjes (moleculen bijvoorbeeld) - eenvoudigweg omdat ze voldoende energie bezitten - uit elkaar vallen, ontleden in een ontledingsreactie.
In dat geval hangt de reactiesnelheid niet af van de aanwezigheid van andere deeltjes.
Dat zijn reacties van de eerste orde (unimoleculair) wat wil zeggen: de deeltjes hoeven niet te botsen met andere deeltjes om tot reactie te komen. Ze kunnen zich spontaan delen in verschillende onderdelen.
Een chemische reactie heeft altijd te maken met "herverdeling van valentie-elektronen op het moment dat bepaalde deeltjes in contact treden met elkaar met voldoende energie.
In dit proces verdwijnen chemische bindingen en worden nieuwe gemaakt. Dat weten we al van module 7.
De reactie is het resultaat van een comlex proces, meestal bestaande uit diverse stappen.
Er zal altijd een eerste stap zijn (initiatie), de volgende stappen(continuatie) en zoiets als een terminatie, dus de eindstappen die de reactie beëindigen.
Al die stappen tezamen noemen we ook wel: het reactiemechanisme. [zie ook wikipedia]
In zo'n mechanisme is altijd zoiets als een "aanval" van bepaalde deeltjes op andere deeltjes. De aanvallende deeltjes hebben normaal gesproken voldoende energie daarvoor (anders lukt de aanval niet); ze zijn energie-rijk.
De aanval wordt geholpen door diverse factoren, zoals de aanwezigheid van een katalysator, van bepaalde lichtstraling, van energie.
Katalysatoren hebben een belangrijke invloed op het mechanisme. Ze doen wel mee, maar komen onveranderd tevoorschijn uit de reactie.
Katalysatoren stimuleren bepaalde stappen van het mechanisme.
In de biochemie spreken we van bio-katalysatoren of enzymen.
In plaats van met een katalysator kan een chemisch proces ook opgestart worden door bijvoorbeeld lichtstraling, die een binding onstabiel maakt en daarmee een deeltje veel reactiever.
Er vormen zich dan geactiveerde deeltjes (met voldoende energie) die de reactie continueren en uiteindelijk ook stoppen.
In de koolstofchemie kennen we twee types reactiemechanismen:
- Er kan een aanval plaats vinden van een positief op een negatief geladen deeltje (elektrofyle aanval) of omgekeerd: een aanval van een negatief op een positief deeltje (nucleofyle aanval).
- Het ander mechanisme is dat van 'radikalen', d.w.z. ongeladen deeltjes die zeer reactief zijn door hun ongepaarde elektron; ladingen spelen hierbij verder geen rol.
Er bestaan chemische reacties waarbij de deeltjes (moleculen bijvoorbeeld) - eenvoudigweg omdat ze voldoende energie bezitten - uit elkaar vallen, ontleden in een ontledingsreactie.
In dat geval hangt de reactiesnelheid niet af van de aanwezigheid van andere deeltjes.
Dat zijn reacties van de eerste orde (unimoleculair) wat wil zeggen: de deeltjes hoeven niet te botsen met andere deeltjes om tot reactie te komen. Ze kunnen zich spontaan delen in verschillende onderdelen.
voorbeeld:
De ontleding van Ozon wordt een 'unimoleculaire' reactie genoemd of ook een reactie 'van de eerste orde'.
nog een voorbeeld:
Kijk eens naar de volgende grafiek van de ontleding van 14C in een eerste-orde-reactie (unimoleculair).
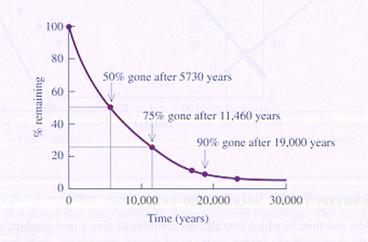
Een ander voorbeeld van een unimoleculaire reactie is de ontleding van N2O4.
Met voldoende energie zal het molecuul zich verdelen in twee delen (NO2).
Verder is dit een zeer elementaire reactie: bestaat uit slechts één stap.
Bovenstaande ontledingsreactie is het omgekeerde van de reactie in de navolgende figuur:
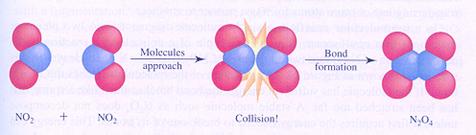
effectieve botsing
De meeste scheikundige reacties zijn niet unimoleculair, maar bimoleculair: twee deeltjes moeten botsen en een effectieve botsing leidt dan tot een reactie.
Dat zijn geen elementaire reacties, ze hebben een gecompliceerd reactiemechanisme met diverse stappen.
Een bimoleculaire reactie verloopt niet automatisch bij elke botsing. De botsing moet 'effectief' zijn.
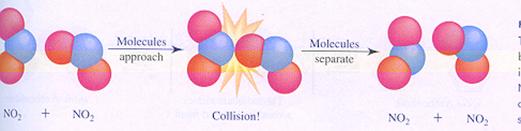
een niet effectieve botsing
Hieronder zie je in de afbeeldingen twee mogelijke (verschillende) mechanismen van de reactie tussen moleculen van stikstofdioxide. Je ziet verschillende stappen.
In geval I botsen twee moleculen en zo start de reactie.
In geval II splitst één molecuul en één van de producten botst met een ander molecuul.
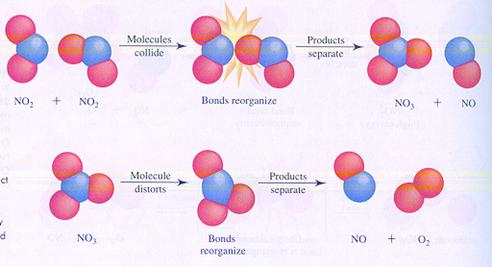
geval I
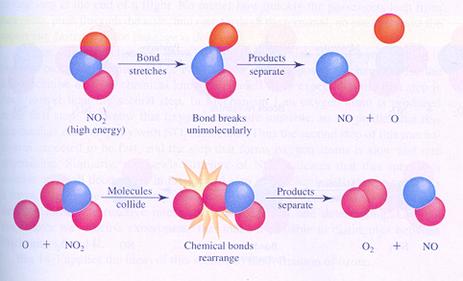
geval II
De reactiviteit van deeltjes.
Er zijn deeltjes met een zeer hoge reactiviteit, die men wel "radicalen" noemt.
Radicalen vormen zich - algemeen gesproken - onder invloed van licht en hebben als eigenaardigheid dat ze één of meer ongepaarde valentie-elektronen bezitten.
Radicalen zijn neutraal.
Voorbeelden: Cl· Br· — C — C — O·
Andere aanvallende deeltjes zijn degene met ladingen. Sommige geladen deeltjes vertonen ook een grote reactiviteit, zoals (+, -, δ+ ou δ-).
We onderscheiden hierbij twee mogelijkheden:
- een negatief deeltje valt aan op een positief deeltje = nucleofyl mechanisme
- een positief deeltje valt aan op een negatief deeltje = elektrofyl mechanisme
Een voorbeeld om uit te zoeken is de organische reactie tussen alkanolen en alkaanzuren in aanwezigheid van de katalysator zwavelzuur
propaanzuur + ethanol
 ethylpropanaat + water (zwavelzuur = katalysator)
ethylpropanaat + water (zwavelzuur = katalysator)




