Reactiesnelheid be´nvloeden
De reactiesnelheid kun je be´nvloeden met verschillende factoren.
Voor de reactiesnelheid is een formule afgeleid waarin de belangrijkste en invloedrijkste factoren zijn opgenomen.
De snelheid hangt af van de concentratie van de reagentia [ ], van de verdeling / het oppervlak van de stof (homogeen of heterogeen),
van de temperatuur (oC of K), en van de eventuele aanwezigheid van een katalysator.
V ≈ [concentratie] x verdeling x energie van de deeltjes x katalysator.
Zo is deze formule tamelijk onbruikbaar. Het is een formule in woorden. We willen graag getallen en symbolen.
Je kunt hem vereenvoudigen door sommige omstandigheden constant te houden en zo alleen de (variabele) concentraties te behouden.
We krijgen dan een wiskundige formule:
V = k.[conc.]n
- V: is de snelheid;
- k: vertegenwoordigt het geheel van constant gehouden overige factoren;
- n: is de coŰfficiŰnt van het reagens in de reactievergelijking;
- Op deze wijze verschijnen de concentraties van elke homogene stof in de formule. Heterogene stoffen laat je weg.
- Een reactie waarbij k een hoge waarde heeft, heeft 'sterke reagentia'
- Een reactie waarbij k een lage waarde heeft, heeft 'zwakke reagentia'
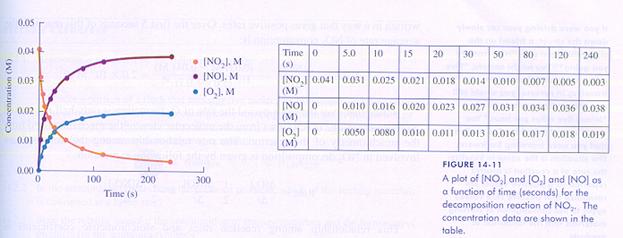
Let op: In de grafiek zie je hoe de concentraties van de reagentia en van de producten veranderen tijdens de reactie. Nu maar hopen dat je snapt dat de concentratie van deze stoffen niet constant kan blijven tijdens de reactie.