Eigenschappen van Zuivere Stoffen
We nemen als voorbeeld zomaar een groepje zuivere stoffen: Jodium, methaan, ammoniak, water, zwaveldioxide en kooldioxide
Het zou mooi zijn als je ergens wat jodium kon zien. Misschien op school? Let wel, jodium voor ontsmetting is een oplossing van puur jodium(s) in een vloeistof.
Zuiver jodium (soms noemt men het jood) is een vaste stof, opgebouwd uit donkerpaarse, bijna zwarte kristallen.
Je zou moeten waarnemen wat er gebeurt als puur jodium verdampt. Jodium smelt namelijk niet, maar gaat van vast meteen over in damp, in gasvorm.
Als het oplost in alkohol krijg je jodiumtinctuur (te koop bij de drogist). Dit is wel het jodium dat prikt (omdat er alkohol in zit).
Er is ook een andere manier om jodium op te lossen: met een truukje in water, en dan prikt het niet als je er een wondje mee ontsmet.
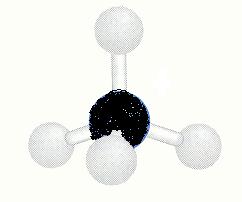
Bekijk nu het onderstaande schema: je ziet modellen van verbindingen met waterstof van elementen uit de tweede periode van het periodiek systeem (C, N en O)
| methaan |
ammoniak |
water |
 |
 |
 |
| CH4 |
NH3 |
H2O |
tetraëder
geen dipool |
dipool |
dipool |
| k.p. 112 K |
k.p. 240 K |
k.p. 373 K |
De binding tussen C en H is nauwelijks polair. De bindingen tussen O en H en de bindingen tussen N en H zijn polair genoeg.
Als een molecuul polaire bindingen bevat, dan zijn er de volgende twee mogelijkheden:
- De ruimtelijk opbouw van het molecuul is zodanig dat de zwaartepunten van positieve en negatieve ladingen niet samenvallen. Dit is het geval bij ammoniak en bij water.
- De zwaartepunten van de negatieve en positieve ladingen vallen wel samen. Het beetje polair karakter van de bindingen tussen C en H in methaan levert geen dipoolmolecuul op. het molecuul is volkomen symmetrisch.
ammoniak zal goed in water oplossen, maar methaan niet.
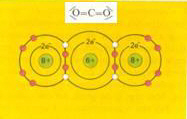
| symmetrisch |
asymmetrisch |
 |
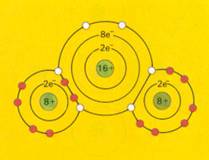 |
SO2 zal ongetwijfeld beter in (het polaire) water oplossen dan CO2
Even ter herinnering:
Het belangrijkste gegeven van een zuivere stof is dat die is opgebouwd uit slechts één soort deeltjes.
Zo is bijvoorbeeld suiker zonder onzuiverheden opgebouwd uit alleen maar sacharosemoleculen (C12H22O11).

