| O elemento é a substância que já não se pode decompor, quimicamente, em outras substâncias. |
|
1. Sistema periódico / grupos e períodos |
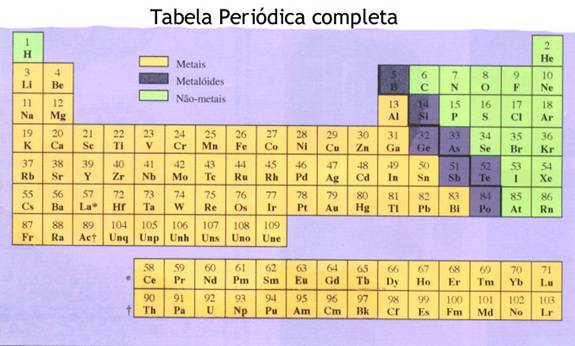
| I | II | III | IV | V | VI | VII | VIII | |
| 1 | H | He | ||||||
| 2 | Li | Be | B | C | N | O | F | Ne |
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar |
| 4 | K | Ca | Ga | Ge | As | Se | Br | Kr |
| 5 | Rb | Rb | In | Sn | Sb | Te | I | Xe |
| 6 | Cs | Bi | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra |
| metais | Cs |
| metalóides | Po |
| não metais | Se |
| Electronegatividade é a tendência de um átomo neutro para atrair carga negativa (electrões) |

| terra | água | fogo | ar |
| Halogéneo | Símbolo | Número atómico |
Massa atómica |
Densidade em g/cm3 |
ponto de fusão em K |
ponto de ebulição em K |
Cor |
| Flúor | F2 | 9 | 19,0 | 1,11 | 53 | 85 | Amarela |
| Cloro | Cl2 | 17 | 35,5 | 1,56 | 172 | 239 | Amarela/verde |
| Bromo | Br2 | 35 | 79,9 | 3,12 | 266 | 331 | Castanha/vermelha |
| Iodo | I2 | 53 | 126.9 | 4,94 | 387 | 456 | Preta (s) |
| F2 | ICl | CO | HS- | Cl2 | HBr | N2 | OH- |