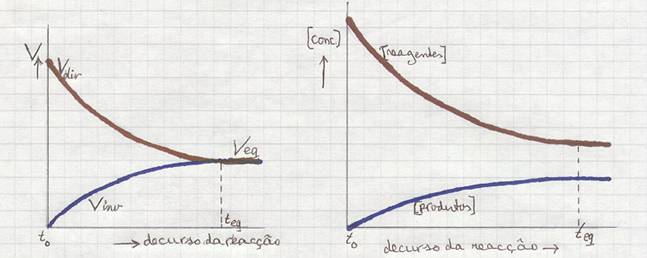
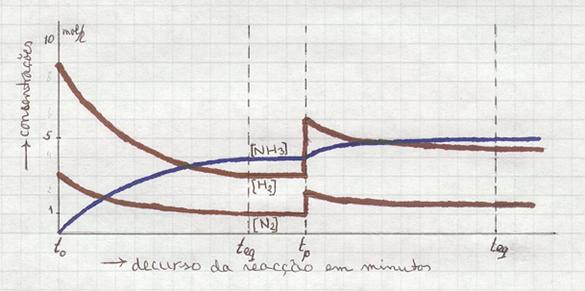
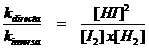Juntar mais Hidrogénio, por exemplo, cria uma deslocação do equilíbrio que faz com que (uma parte de) este Hidrogénio extra desapareça (parcialmente); isto vai estimular a reacção directa.
Tudo até atingir um novo equilíbrio.
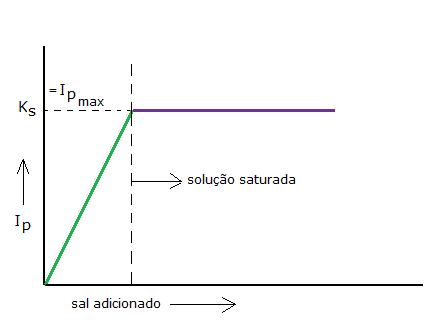
-
 No copo encontra-se NH3(aq) (meio básico) com umas gotas do indicador vermelho de metil,
No copo encontra-se NH3(aq) (meio básico) com umas gotas do indicador vermelho de metil,
cuja fórmula é abreviada: HIn
Realiza-se na solução o seguinte equilíbrio:
HIn H++ In-
H++ In-
Vermelho Amarelo
A presença da base (que capta H+) implica uma deslocação do equilíbrio para direita domina a cor amarela
domina a cor amarela
-
 Juntamos um pouco de HCl(aq), assim mudando o meio básico para meio ácido.
Juntamos um pouco de HCl(aq), assim mudando o meio básico para meio ácido.
O ácido quer ceder H+, portanto,
o equilíbrio: HIn H++ In-
H++ In-
Vermelho Amarelo
desloca-se para esquerda e a cor muda para vermelho
-
 De novo acrescentando base (NH3(aq)), a cor muda mais uma vez para amarela
De novo acrescentando base (NH3(aq)), a cor muda mais uma vez para amarela
o mesmo equilíbrio desloca-se de novo para direita:
HIn H++In-
H++In-
Vermelho Amarelo
-
 Sem fim podemos continuar assim;
Sem fim podemos continuar assim;
cada vez o equilíbrio deslocando para direita ou para esquerda.
A situação dentro do copo quase não muda;
só desloca-se o equilíbrio para um ou para outro lado, depende do ambiente.
Um volume maior implica que haverá mais espaço para as partículas participantes no equilíbrio.
Contrariar esta mudança somente será possível quando o equilíbrio cria mais partículas.
Mudar o volume pode acontecer de várias maneiras: no caso de gases, as partículas directamente sentem mais ou menos espaço; no caso de soluções, mudar o volume pode ser realizado através duma diluição. O efeito afinal é igual.
No exemplo de HI, isto não será possível porque aos dois lados contamos um número igual de partículas (2:2), portanto, neste caso, mudar o volume não vai ter nenhuma influência.
Fornecimento de energia extra a um equilíbrio químico só pode ser contrariado pelo sistema por estimular a reacção endotérmica
(no exemplo de HI haverá deslocação para esquerda)
O equilíbrio de sacarose (no exercício) é exotérmico para direito:
glicose + frutose
Isto implica que às temperaturas mais baixas, haverá menos energia disponível; o equilíbrio quer 'criar' energia, que pode ser realizado pela reacção exotérmica, portanto, a reacção para direita.
Então, às temperaturas mais baixas, forma-se mais sacarose.