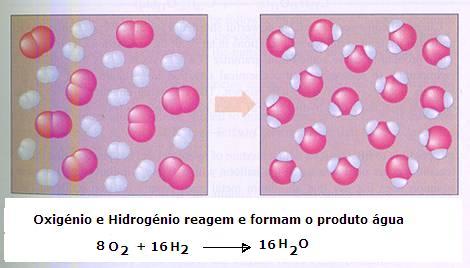
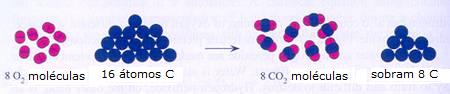
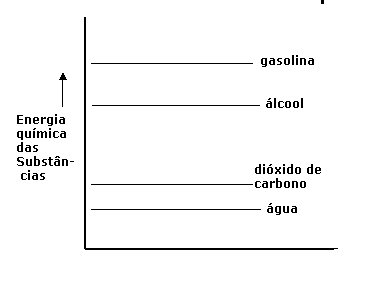
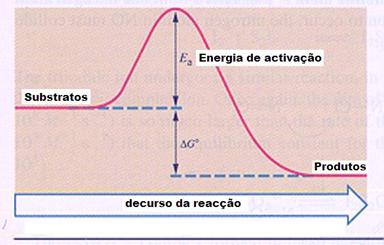
|
Regras principais na resolução de cálculos estequiométricos |
| 1 |
Elaborar uma equação acertada da reacção. Incluir os estados físicos |
| 2 |
Sublinhar as substâncias sobre as quais existem dados ou há perguntas.
Os dados podem surgir directamente ou indirectamente.
O cálculo continua somente com as substâncias sublinhadas; as eventuais outras substâncias ficam fora
|
| 3 |
Nota bem a proporção molar |
| 4 |
Transferir, se for necessário, moles para as unidades apropriadas |
| 5 |
Introduzir um factor para respeitar as quantidades reais, assim terminando o cálculo |