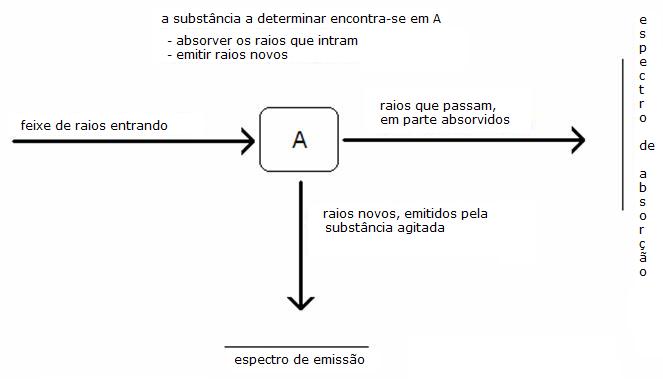
Às vezes podemos fazer, durante uma termólise, observações que dão informação específica sobre a substância e tirar conclusões sobre o carácter da mesma.
De modo geral, começamos aquecer cuidadosamente a substância pura, para depois continuar com aquecimento forte num tubo próprio.
exemplos:
- CuSO4.5H2O (azul)
 CuSO4 (branco) + 5H2O(g)
CuSO4 (branco) + 5H2O(g)
- Cu(OH)2(s)(azul)
 CuO(s)(preto) + H2O(g)
CuO(s)(preto) + H2O(g)
- 2CuOH(s)(verde)
 Cu2O(s)(vermelho acastanhado) + H2O(g)
Cu2O(s)(vermelho acastanhado) + H2O(g)
- 2AgOH(s)(castanho)
 Ag2O(s)(preto) + H2O(g)
Ag2O(s)(preto) + H2O(g)
C6H12O6(s) > C(s) + gases (H2O, CO2, CxHy e outros)
- Pb(NO3)2(s)(branco)
 PbO(s)(laranja) + NO2(g) + NO(g) + O2(g) (os vapores nitrosos castanhados)
PbO(s)(laranja) + NO2(g) + NO(g) + O2(g) (os vapores nitrosos castanhados)
- CaCO3(s)(branco)
 CaO(s)(branco) + CO2(g)
CaO(s)(branco) + CO2(g)