Enkele vragen met hun antwoorden
Opdracht 01-03
Atomen met een zeer hoog atoomnummer (>92) zijn niet meer stabiel (te houden).
Wat kan de reden zijn daarvan?
Antwoord
Atomen met een zeer hoog atoomnummer hebben dus ook zeer veel protonen. In een stabiele kern zullen de aanwezige neutronen erin slagen om de onderlinge afstotende werking van al die positieve deeltjes op te heffen.
Als het er echter al te veel worden, dan gaat dat niet meer. Dan zal ook de nabijheid van die neutrale deeltjes niet meer de afstoting kunnen voorkomen tussen die protonen.
Opdracht 01-09
Edelgassen hebben een gelijksoortige elektronenverdeling; Helium heeft niet 8 valentie-elektronen, maar is toch edelgas. Leg uit.
antwoord:
De edelgassen reageren niet omdat ze een 'volle' buitenste hoofdschil hebben, verzadigd met elektronen. Dat zijn er normaal 8.
Helium heeft er maar 2, maar heeft ook maar één hoofdschil. En die eerste hoofdschil is volledig tevreden met 2 elektronen; meer kan die niet hebben.
De eerste hoofdschil heeft slecht één orbitaal s, die maximaal 2 elektronen bezit.
Opdracht 01-17
Natuurlijk koolstof is samengesteld uit 98,89% koolstof-isotoop 12C
De relatieve atoommassa's der isotopen is 12,000 voor 12C en 13,003 voor 13C
Bereken de atoommassa van dit element.
Antwoord
De atoommassa is een gemiddelde van de massa's der isotopen.
Daarbij moet je echter wel rekening houden met de percentages van die isotopen.
Als er dus heel erg veel 12C is een heel erg weinig 13C, dan zal natuurlijk de atoommassa dichter bij de 12 dan bij de 13 liggen.
98,89 % van koolstof is 12C, dus: 1,11 % is 13C
De bijdrage van 12C aan de totale atoommasse is: 0,9889 x 12,000 = 11,87
De bijdrage van 13C aan de totale atoommassa is: 0,011 x 13,003 = 0,14
Dus zal de gemiddelde atoommassa van koolstof zijn: 11,87 + 0,14 = 12,01
Opdracht 02-06
- Bepaal de plaats van atoomnummer 18 in het PS en geef de elektronenconfiguratie.
- idem voor nummer 23.
- Een element zit in hoofdgroep V en in de derde periode. Wat is zijn atoomnummer?
Antwoord:
a.
atoomnummer 18
elektronenconfiguratie = 1s2 2s2 2p6 3s2 3p6 = 2 - 8 - 8 (hoofdindeling)
met 8 valentie-elektronen zal het een edelgas zijn, dus in de achtste hoofdgroep.
eindigend in p zal het een element uit blok p zijn.
met drie hoofdschillen staat dit element in de derde periode.
b.
atoomnummer 23
elektronenconfiguratie = 1s2 2s2 2p6 3s2 3p64s23d3 = 2 - 8 - 11 - 2
met 2 elektronen in de buitenste hoofdschil zal het een metaal zijn, maar niet uit de tweede hoofdgroep, want het element eindigt in d-nivo
het is dus een element uit blok d
er zijn vier hoofdschillen dus staat het element in periode 4
c.
hoofdgroep 5 eindigt in s2 p3 dat zijn dus 5 elektronen in de buitenste hoofdschil.
de derde periode houdt in dat er drie hoofdschillen zijn, dus is er maar één mogelijke elektronenconfiguratie: 1s2 2s2 2p6 3s2 3p3 = 2 - 8 - 5
omdat er 2+8+5 = 15 elektronen in de schillen zitten, moet het atoom in de kern 15 protonen hebben.
het atoomnummer is dus 15.
Opdracht 02-11
Leg uit waarom Fluor de meest reactieve is van de halogenen.
Antwoord:
Fluor staat in de zevende hoofdgroep helemaal bovenaan. Dat betekent automatisch dat fluor de hoogste elektronegativiteit heeft van alle halogenen. Dat komt omdat, in vergelijking met Chloor en de andere halogenen, het fluoratoom de kleinste atoomstraal heeft (slechts 2 hoofdschillen) De kern van Fluor zal dus de elektronen in die twee schillen (negatieve lading) sterk naar zich toe trekken.
Het neutrale atoom als zodanig behoudt - naar buiten toe - die aantrekkingskracht op negatieve lading. De negatieve lading kan namelijk behoorlijk dicht bij die kern komen.
Het is deze eigenschap die fluor zo reactief maakt.
Opdracht 02-13
Is de volgende bewering waar of vals?
"De edelgassen hebben een zeer lage ionizatie-energie"
Leg je antwoord uit.
Antwoord
De edelgassen hebben een grote stabiliteit, dus zal het niet gemakkelijk zijn hun elektronenstructuur te wijzigen.
elektronen verwijderen om positieve ionen te vormen zal dus erg veel energie kosten.
Dus staat hierboven geen juiste bewering. Het omgekeerde is waar!
Opdracht 02-16
Normaal gesproken heeft een atoom een voorkeur voor 8 valentie-elektronen. Met dat gegeven moet je van de volgende moleculen de elektronenformules geven:
F2 CO N2 HS- OH-
Leg ook uit of je polariteit verwacht in het molecuul.
Antwoord:

In F2, in CO, in N2 valt geen of weinig polariteit te verwachten omdat er weinig of geen verschil is in de elektronegativiteit van de aan elkaar gekoppelde atomen.
In HS- en in OH- mag je die polariteit wel verwachten.
Opdracht 02-17
Zal het molecuul dichloormethaan polair zijn? Leg uit.
Antwoord:
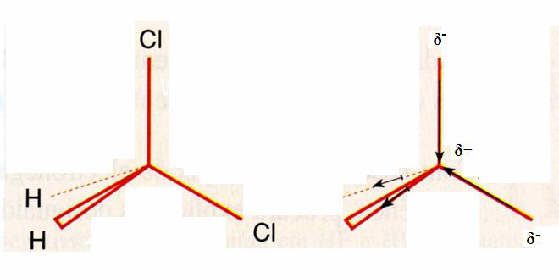
In bovenstaande figuur kun je zien dat de negatieve ladingen aan een kant zitten van het molecuul, dus dat het molecuul een tweepolig karakter zal hebben. Je kunt het molecuul verdelen in twee ongelijke helften.
Het verschil in elektronegativiteit tussen koostof en chloor is voldoende groot om effectief te zijn.

Opdracht 03-10
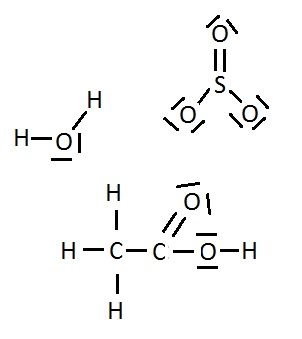
Controleer in elke structuur:
- of het totaal aantal valentie-elektronen juist is en
- of de atomen er in geslaagd zijn een stabiele elektronenverdeling te realiseren.
Alle atomen, behalve H, hebben vier streepjes om zich heen, ofwel; 8 valentie-elektronen. De H-atomen hebben één streepje, dus twee valentie-elektronen.
Dat wil dus zeggen dat alle atomen een stabiele situatie bereikt hebben.
Opdracht 03-19
Een watermolecuul heeft geen lineaire structuur, maar is driehoekig. Dit kleine verschil heeft grote gevolgen in onze wereld.
Beschrijf kort die gevolgen..
Antwoord:
Als het watermolecuul lineair was, dus de twee H- en het O-atoom allemaal op één lijn, dan zou het molecuul als geheel niet polair zijn; geen dipool zijn.
Dan zouden de moleculen veel en veel minder onderlinge aantrekking op elkaar uitoefenen dan in werkelijkheid het geval is met de driehoekige watermoleculen.
Zonder die aantrekkingskrachten zouden de watermoleculen (ze zijn zeer klein en licht) geen vloeistof, maar een gas vormen, net als kooldioxide.
Oftewel, er zouden geen zeeën zijn, geen rivieren, geen regen, geen leven.
Opdracht 03-25
Noem een stof (+ formule) die twee metalen bevat en een niet-metaal, met twee bindingstypen: ion- en atoombinding.
Antwoord:
Dat zou bijvoorbeeld K2Cr2O7 kunnen zijn.
Deze stof heeft ionbindingen tussen K+ en dichromaat Cr2O72-
En heeft atoombindingen tussen Chroom en Zuurstof (in een samengesteld ion).
Opdracht 03-27
Moleculen van de Halogenen hebben relatief lage kookpunten, maar wel onderling verschillend.
Leg die verschillen uit, waarbij het tabellenboek gebruikt mag worden (tabel V).
Antwoord:
Enkele gegevens uit die tabel V over kookpunten (kolom 7, in Kelvin!!)
element |
symbool |
atoom- nummer |
massa- getal |
elektro- negativiteit |
smeltpunt |
kookpunt |
atoom straal x 10-12m |
ion straal x 10-12m |
>vanderwaals straal x 10-12m |
Fluor |
F |
9 |
19,0 |
4,0 |
54 |
85K= -152oC |
64 |
133 |
135 |
Chloor |
Cl |
17 |
35,5 |
3,2 |
172 |
239K= -152oC |
99 |
181 |
180 |
Broom |
Br |
35 |
79,9 |
3,0 |
266 |
332K= -34oC |
114 |
196 |
195 |
Iodium |
I |
53 |
126,9 |
2,7 |
387 |
458K= 59oC |
133 |
219 |
215 |
Astatium |
At |
85 |
2,2 |
575 |
610K= 185oC |
140 |
Dat zijn relatief lage temperaturen omdat de intermoleculaire bindingen zwak zijn (er is geen polariteit).
De verschillen zijn te danken aan het feit dat de moleculen steeds grotere massa hebben (zie kolom 4).
Zwaardere moleculen worden moeilijker gasvormig; de vanderwaals krachten nemen dan toe.
Opdracht 04-08
Het zwavelzuurmolecuul heeft een struktuurformule. Geef een mogelijk struktuurformule.
Antwoord:
De molecuulformule is: H2SO4. Dus: 1 molecuul bevat 2 atomen H, 1 atoom S en 4 atomen O.
- éen waterstofatoom bezit éen (valentie)elektron
- éen zwavelatoom bezit 6 (valentie)elektronen
- éen zuurstofatoom bezit 6 (valentie)elektronen
- éen zwavelzuurmolecuul bevat
| totaal: 2 | |
| totaal: 6 | |
| totaal: 24 | |
| in totaal 32 valentie-elektronen = 16 streepjes. |
- Altijd directe koppeling tussen gelijke atomen vermijden (behalve C); dus geen twee O-atomen aan elkaar.
- De waterstofatomen hebben maar één binding dus zitten altijd aan de buitenkant van het molecuul
- Het zwavelatoom verblijft in het centrum
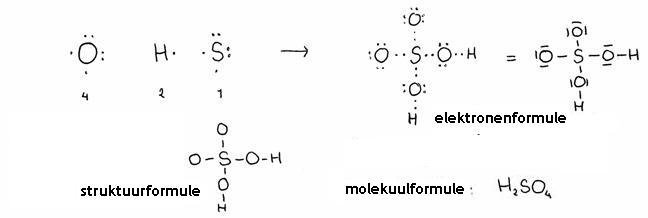
Controleer het totaal aantal valentie-elektronen in de elektronenstruktuur. Zijn er geen elektronen verloren gegaan?
Opdracht 04-09
Leg het zure karakter uit van het ammonium-ion, door alleen maar een reactievergelijking op te schrijven.
Antwoord
In water:
NH4+ + H2O
Het ammonium-ion geeft dus een ion H+ af (aan water) en elke stof die H+ afstaat is een zuur.
Deze oplossing bevat meer H3O+ dan normaal.
Opdracht 04-17
Welke bindingstypen bevinden zich in een propeen-molecuul?
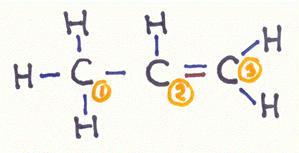
Antwoord:
C1
heeft vier bindingen van het type σ
(lineaire overlapping van de sp3-hybride: 3 met s1-orbitalen van het H-atoom en 1 met sp3-hybride van C2
C2
heeft 3 bindingen van het type σ (lineaire overlapping van de sp2-orbitaal:
1 met de 1s1-orbitaal van het H-atoom, 1 met de sp3-hybride van de C1 en 1 met de sp2-hybride van de C3)
heeft 1 binding van het type π (parallelle overlapping van de 2pz-orbitaal met de 2pz-orbitaal van de C3)
C3
heeft 3 bindingen van het type σ (lineaire overlapping van de sp2-hybride:
2 met 1s1-orbitalen van de H-atomen en 1 met de sp2-hybride van de C2)
heeft 1 binding van het type π (parallelle overlapping van de 2pz-orbitaal met de 2pz-orbitaal van de C2)
Opdracht 04-19
Beantwoord de volgende vragen over de structuren A, B, C e D:
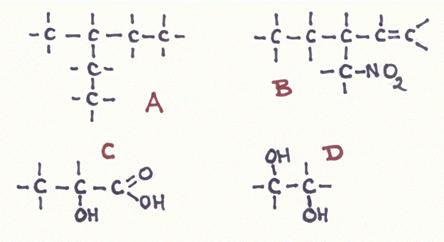
- Geef de officiële naam van elke structuur;
- Hoeveel secundaire C-atomen heeft elke structuur?
- Heeft éen van de structuren een secundaire OH-groep?
- Zijn in alle gevallen de hoofketens ook de langste ketens?
Antwoord:
a.
Het model van A toont overduidelijk dat er geen verwarring kan bestaan over de vertakking en dat het metyl is. De naam hier is: 3-metyl pentaan.
Je moet goed weten dat de hoofdketen - over het algemeen - de langste is; maar niet altijd!!
Soms kan dat niet.
bijvoorbeeld: als in de structuur - ergens in de keten - een dubbele binding zit of er zit een functionele groep aan vast, dan moet je als hoofdketen de langste keten nemen die die dubbel binding of die functionele groep omvat.
De naam van B wordt dan:1-buteen (hoofdnaam), met daaraan een vertakking (etyl) en een functionele groep (nitro).
De naam: 4-nitro, 3-etyl, 1-buteen
Wat de nummering betreft zou het ook kunnen zijn:1-nitro,2-etyl, 3-buteen probeer dat maar eens uit te leggen.
Let op: strukturen op papier kunnen verwarring geven omdat ze niet driedimensionaal zijn. Je ziet ze in het platte vlak.
De triviale naam van structuur C is melkzuur, maar natuurlijk heeft ie een officiële naam.
De hoofdketen heeft 3 C-atomen met alleen maar enkelvoudige bindingen, dus: propaan.
Die met de carboxylgroep is automatisch het C-atoom nummer 1 dus zit de OH-groep aan nummer 2.
De officiële naam moet zijn: 2-hydroxi propaanzuur.
Struktuur D is een diol, met twee alkoholgroepen. De hoofdketen bevat slechts twee C-atomen zonder dubbele binding, dus:
de hoofdnaam moet etaan zijn, met twee groepen OH.
Namen: Etaan 1,2-diol of ook: 1,2-dihydroxi etaan.
Let op: Elke functionele groep of elke vertakking krijgt zijn eigen nummer.
b.
Een C-atoom dat aan slechts 1 ander C-atoom is verbonden, heet een primair C-atoom.
Een secundair C-atoom zit vast tussen twee andere C-atomen.
Struktuur A bezit 2 secundaire C-atomen en structuur B net zo.
Struktuur C heeft 1 en structuur D heeft geen secundaire C-atomen.
c.
Een secundaire hydroxigroep moet verbonden zijn aan een secundaire C-atoom.
Dit vind je in structuur C.
d.
In geval B zien we een keten met 4 C-atomen (niet de langste!).
Toch moet je die als de hoofdketen kiezen, omdat die keten zowel de dubbele binding als de nitro-groep bevat.
Opdracht 04-24
Geef de naam van de volgende chemische structuur; en controleer of de modellen aan het eind juist zijn.
(zonder daarbij te letten op de kleuren van de modellen. De foto's vertonen hier niet de gebruikelijke modelkleuren).
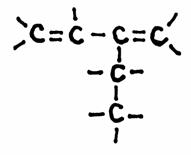
Antwoord:
De structuur heeft een keten van 5 C-atomen en dus zou de hoofdnaam met penta... moeten beginnen.
Er zijn echter dubbele bindingen en die moet je in de hoofdketen opnemen.
Dus, de hoofdketen moet die dubbele bindingen omvatten en heeft dan maar 4 C-atomen; de hoofdnaam begint met but.....
Een zijketen van twee C-atomen krijgt de naam etyl
Had de hoofdketen slechts één dubbele binding, dan zou de naam buteen zijn, maar er zijn twee dubbele bindingen; vandaar: di-een
Ook moet nog eens duidelijk gemaakt worden waar die dubbele bindingen zich bevinden in de hoofdketen.
De twee dubbele bindingen zitten aan de C-atomen 1 en 3: 1,3 butadieen
De vertakking zit vast aan C-atoom 2 (of 3, maar we proberen altijd zo laag mogelijk te nummeren): de volledige naam is dus: 2-etyl 1.3. butadieen
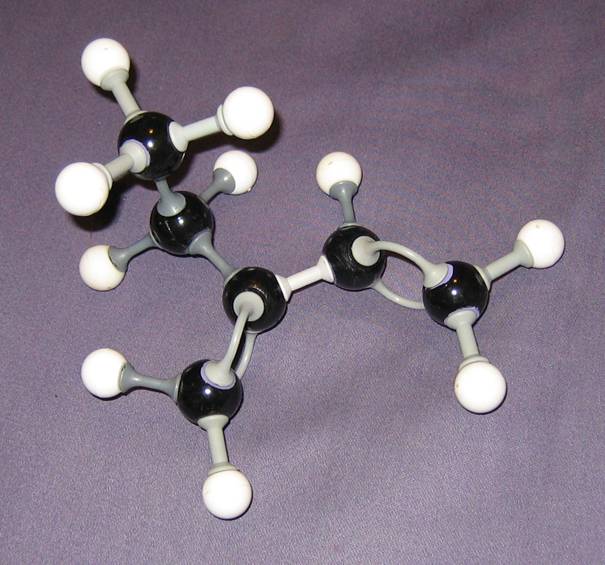
Iets over de modellen hieronder:
In principe zijn alle modellen okay. De eerste toont de koolstof- en waterstofatomen, de tweede alleen maar de bindingen naar die waterstofatomen (maar zelf zijn die witte bolletjes weggelaten) en de derde is alleen maar het zogenaamde koolstofskelet van het molecuul.
Op papier is het moeilijk driedimensionale strukturen te tekenen, maar aan goede modellen kun je zien dat de richting van atomen kan verschillen.


Opdracht 04-28
Geef de officiële naam van Valine (een van de aminozuren)
Antwoord:
De struktuur van Valine:
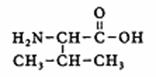
We herkennen een hoofdketen met 4 C-atomen en een carboxylgroep:
Hoofdnaam: butaanzuur
+ een aminogroep op plek 2
+ een metylgroep op plek 3
Dus: de officiële naam moet zijn: 2-amino, 3-metyl, butaanzuur
Opdracht 04-32
Kijk goed naar de volgende strukturen:
1)
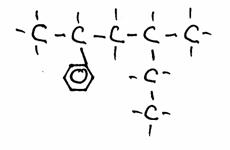
2)
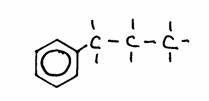
3)
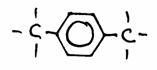
- Geef de naam van elke struktuur. Indien mogelijk, geef nog een naam.
- De strukturen 2) en 3) zijn isomeren? Ja of Nee? Leg uit.
a)
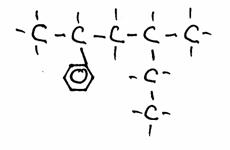
2-fenyl, 4-metyl-hexaan
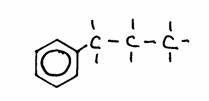
1-fenyl-propaan; of: propyl-benzeen

1,4-dimetyl-benzeen of: para-dimetyl-benzeen (= p-dimetylbenzeen)
N.B.
In struktuur 1) kies je de hoofdketen met het hoogste aantal C-atomen (=6); je kunt hier benzeen beschouwen als een functionele groep.
In struktuur 2) mag nummer 1 niet ontbreken; er bestaat ook 2-fenyl propaan. Let op: 3-fenyl propaan is fout! (waarom?)
Benzeen kan hier een functionele groep zijn, maar ook als hoofdketen worden beschouwd.
b)
De empirische formules van de drie stoffen zijn verschillend. Er is geen isomerie.
Opdracht 05-03
Stel je een stof voor die opgebouwd is uit zeer beweeglijke deeltjes: klein, licht en met weinig aantrekkingskracht.
Zal die stof vast zijn, vloeibaar of gas? Leg je antwoord uit.
Antwoord:
Deze deeltjes zullen elkaar onderling zo slecht aantrekken dat ze heel gemakkelijk ver van elkaar weg blijven. Slechts met veel moeite zal het mogelijk zijn deze deeltjes samen te brengen en samen te houden, dus bij zeer lage temperatuur en zeer hoge druk.
Oftewel, deze deeltjes zullen in de praktijk een gasvormige stof vormen.
Opdracht 05-05
Denk je dat het totaal aantal mensen op aarde meer of minder zal zijn dan 1 MOL? Maak een schatting.
Antwoord:
Het totaal aantal mensen op aarde zal in de buurt van 8 miljard liggen.
Dat is: 8.000.000.000 = 8 x 109
1 MOL = 600.000.000.000.000.000.000.000 = 6 x 1023
1 MOL is dus veel en veel meer dan 8 miljard. Er wonen dus bij lange na niet 1 MOL mensen op aarde. Gelukkig maar!!
Opdracht 05-10
Waar of onwaar? Leg uit!
12 g Koolstof bevat 1 mol atomen
Antwoord:
Het element Koolstof heeft volgens de tabel een atoommassa van 12
op microniveau betekent dat: de kern bevat 12 kerndeeltjes (6 protonen + 6 neutronen)
op macroniveau betkent dat: 1 MOL koostofatomen wegen 12 x 1 gram
De bewering klopt dus als een bus.
Opdracht 05-20
Als je bier opvat als een mengsel van water en alkohol, wat voor type mengsel is dat dan?
antwoord:
Zowel alkohol als water zijn bij kamertemperatuur vloeistoffen. Allebei zijn ze polar, dus ze mengen prima homogeen.
We hebben hier dus een homogeen mengsel van (l) + (l)
Opdracht 05-23
Stel dat je een literfles bier kapot laat vallen. Het bier heeft een Vol% van 6 (zwaar bier dus). dichtheid van alkohol is 0,8.
Hoeveel moleculen alkohol heb je dan laten vallen?
antwoord:
Een liter is 1000 ml en 6 volumeprocent daarvan is 6 x 10 = 60 ml
Dus viel er 60 ml alkohol op de grond.
de dichtheid is 0,8 g/ml → 1 ml alkohol = 0,8 gram alkohol → 60 ml alkohol = 60 x 0,8 = 48 gram alkohol
er viel dus 48 gram alkohol op de grond
de molecuulmassa van alkohol = 2xC + 6xH + 1xO = 24 + 6 + 16 = 46.
D.w.z. dat 46 gram alkohol = 1 MOL alkohol = 6 x 1023 alkoholmoleculen
Zie je dat 48 gram net ietsje meer is dan 1 MOL? Om precies te zijn 48/46 x zoveel:
er vielen dus 48/46 x 6 x 1023 moleculen alkohol op straat. = 6,26 x 1023 = 626.000.000.000.000.000.000.000 moleculen. Dat zijn er nogal wat!
Maar och, je kunt ze beter op de grond laten vallen dan dat ze je hersencellen verhinderen te groeien.
Opdracht 05-28
Zoek in tabel 5 of in een andere tabel de derde periode van het PS op en
- noteer de E(lektronegativiteit) voor elk element;
- noteer ook de atoomstraal van elk element en
- leg uit waarom deze straal steeds kleiner wordt.
Antwoord:
| 1 = elementen |
2 = symbool |
3 = atoom- nummer |
4 = atoom- massa |
5 = electro- negati- viteit |
6 = smeltpunt |
7 = kookpunt |
8 = atoom- straal (x10-12m) |
9 = ion- straal (x10-12m) |
10 = v-d-Waals straal (x10-12m) |
| Natrium | Na | 11 | 23,0 | 0,9 | 371 | 1156 | 186 | 98 | |
| Magnesium | Mg | 12 | 24,3 | 1,2 | 923 | 1363 | 160 | 65 | |
| Aluminium | Al | 13 | 27 | 1,6 | 933 | 2792 | 143 | 45 | |
| Silicium | Si | 14 | 28,1 | 1,9 | 1687 | 3538 | 117 | 224 | |
| Fosfor | P | 15 | 31,0 | 2,1 | 317 | 550 | 110 | 212 | 190 |
| Zwavel | S | 16 | 32,1 | 2,5 | 388 | 718 | 104 | 190 | 185 |
| Chloor | Cl | 17 | 35,5 | 3,2 | 172 | 239 | 99 | 181 | 180 |
| Argon | Ar | 18 | 39,9 | 84 | 87 | 192 |
Als je goed kijkt zie je dat van links naar rechts in deze periode de atoomstraal elke keer kleiner wordt. Dat heeft te maken met het feit dat al deze atomen een gelijk aantal elektronenschillen heeft, maar dat de kernlading steeds groter wordt.
D.w.z.: de aantrekkingskracht van de kernlading op de negatieve elektronen neemt dus steeds toe; de kern trekt de schillen steeds dichter om zich heen.
Daarom wordt het atoom naar rechts in een periode kleiner.
Opdracht 05-39
Plaats de volgende stoffen in volgorde van toenemend kookpunt:
water, stikstof, hexaan, 2.3-dimethylbutaan, glycerol.
Antwoord:
Je moet de stoffen onderzoeken op de volgende eigenschappen: (in volgorde van belangrijkheid)
- Ladingskrachten tussen de deeltjes onderling (zijn het ionen of dipoolmoleculen?)
- vdWkrachten; dus de M vergelijken.
- De ruimtelijke vorm van de deeltjes
Moeilijk koken betekent: hoger kookpunt.
Dus de stoffen met lagere kookpunten zijn stikstof, hexaan, 2.3-dimethylbutaan
De stoffen met de hogere kookpunten zijn water en glycerol
- stikstof is veel lichter dan hexaan en 2.3-dimethylbutaan
- hexaan en 2.3-dimethylbutaan zijn even zwaar
- water is veel lichter dan glycerol
hexaan heeft een langwerpig molecuul, lineair
2.3-dimethylbutaan heeft een veel meer bolvormig molecuul en ontsnapt dus gemakkelijker → lager kookpunt.
De uiteindelijke volgorde in opklimmend kookpunt zal dus zijn:
stikstof - hexaan - 2.3-dimethylbutaan - water - glycerol
Opdracht 05-42
bewering: "Tijdens verdamping van vast I2 vormen zich jodium-atomen."
Is deze bewering waar of onwaar? Leg uit
Antwoord
Jood of Jodium heeft de molecuulformule I2, d.w.z. elk molecuul is opgebouwd uit twee atomen (door atoombinding aan elkaar gebonden).
Bij verdamping vindt het volgende proces plaats:
I2(s) → I2(g)
Verdamping is geen scheikundige reactie: de atoombindingen worden niet verbroken. Alleen de intermoleculaire binding (hier vanderWaalsbindingen) worden overwonnen.
Dus de moleculen I2 veranderen zelf niet.
Er worden dus geen losse atomen gevormd.
De bewering is onwaar.
Opdracht 05-50
Denk je dat het mogelijk is om een (g) + (g) mengsel door papierchromatografie te scheiden in de komponenten? Leg uit.
Antwoord
Een mengsel van meerdere gassen kan alleen behandeld/onderzocht/gescheiden worden in een afgesloten ruimte, zodat de gassen niet kunnen ontsnappen.
Bovendien moet je alle gasdeeltjes dwingen tegelijkertijd door een bepaalde smalle en afgesloten ruimte voort te bewegen
Papierchromatografie vindt vaak wel plaats in een soort afgesloten ruimte, maar houdt geen rekening met het wegdampen van de te onderzoeken stoffen. De opstelling is veel te open voor gassen. Verder werkt papierchromatografie op basis van een loopvloeistof, terwijl gassen meegevoerd moeten worden met een draaggas.
Het zal dus moeilijk of zelfs onmogelijk zijn om gassen m.b.v. papierchromatografie te scheiden in komponenten.
Opdracht 05-60
In ons lichaam worden die energierijke stoffen omgezet in producten. Betreft het hier exotherme of endotherme reacties?
Antwoord
Als ons lichaam (in het metabolisme) voedingsstoffen omzet tijdens chemische reacties (tijdens de spijsvertering), dan is de hoofdbedoeling daarvan om het lichaam van energie te voorzien. Als je eet krijg je energie. De daarvoor belangrijkste voedingsstoffen, dus die met veel energie, zijn suikers en olie en vet.
porteïnen zijn niet zozeer om je lichaam van energie te voorzien, maar meer om nieuwe stoffen op te bouwen (waar weer energie voor nodig is).
Dus energierijke stoffen (bijvoorbeeld suikers) worden omgezet in energiearmere stoffen (bijv. koolzuurgas en water). Daarbij komt energie vrij die het lichaam voor andere dingen gaat gebruiken. Als er bij een chemische reactie energie vrij komt, dan spreken we van een exotherme reactie.
Opdracht 06-05
Wat is de belangrijkste eigenschap van het watermolecuul die verantwoordelijk is voor het vloeibaar zijn van water (terwijl je toch weet dat water een heel kleine molecuulmassa heeft)?
Antwoord
Neem nu eens een molecuul dat net zo klein is en ongeveer net zo zwaar, bijvoorbeeld ammoniak of aardgas. Die moleculen blijven gasvormig en water niet; dus aan de massa kan het niet liggen.
De reden moeten we zoeken in de sterke polariteit van het watermolecuul.
De ene kant van het watermolecuul (die van de H-atomen) heeft een tamelijk positieve lading en de andere kant (die van het O-atoom) heeft juist een nogal negatieve lading.
Als zulke moleculen bij elkaar komen zal de negatieve kant van het ene molecuul de positieve kant van een ander molecuul naar zich toe trekken. Zo is er een flinke aantrekkingskracht tussen de watermoleculen onderling. Daarom is het niet gemakkelijk ze van elkaar te halen.
Gasvorming (verdamping) betekent dat de watermoleculen toch van elkaar af moeten. Het kost dus heel wat energie/warmte om vloeibaar water te verdampen / te koken / gasvormig te maken.
Zonder dat polaire karakter zou water helemaal niet vloeibaar zijn, zouden er geen rivieren zijn, geen regen, geen oceanen en zouden we geen aarde hebben zoals die er nu uit ziet.
Opdracht 06-11
In de negentiende eeuw ontstond een speciale theorie over vuur. Men voerde een nieuw begrip in: "flogiston". Dit zou een zeer vluchtige stof zijn die ontsnapt uit een brandende stof. Zo heel gek is dat niet gedacht, want als je iets verbrandt zie het verschrompelen tot as.
Later werd deze theorie verworpen doordat er proeven gedaan werden. In die proeven hebben ze het gewicht bepaald van stoffen voor en na de verbranding. De gedane waarnemingen, observaties, bevestigen absoluut niet het bestaan van zoiets als 'flogiston'; integendeel.
Probeer de redenering van dat bewijs te geven.
Antwoord
Stel dat er onderzoek gedaan wordt met 5 gram hout. Dat wordt in een weegschaaltje gelegd en continu gewogen, ook tijdens de verbranding. Je begrijpt dat er alleen wat as overblijft.
Het gewicht van die as is veel minder dan 5 gram, dus zo gek was het niet dat men vroeger dacht dat er iets verdween tijdens die verbranding.
Maar tegenwoordig weet men dat er gasvormige stoffen ontstaan (ook al zie je die niet). In dit geval ontstaat er veel kooldioxide en waterdamp.
Ze hebben toen de proef zo gedaan dat alle producten, dus koolzuurgas, water en as, verzameld worden en gewogen. Wat blijkt dan?
Het gewicht van het koolzuurgas + het water + de as is duidelijk méér dan 5 gram. De producten zijn dus zwaarder dan de oorspronkelijke vijf gram hout. Er zal dus geen massa verdwijnen tijdens een verbranding.
Eventjes heeft men nog gedacht aan een ontsnappende stof met negatief gewicht, maar dat vonden de meeste wetenschappers toch te vergezocht.
Later is ontdekt dat bij de verbranding zuurstof ook een reagens is, die mee reageert.
Als je dan de 5 gram hout + het benodigde zuurstof weegt en dat vergelijkt met de totale massa van de producten, dan blijkt dat gelijk te zijn.
Opdracht 07-02
Een zout oplossen in water, is dat een natuurkundig of een scheikundig proces?
Antwoord
Een echte scheikundige reactie is het niet, de stoffen veranderen niet echt, er zijn geen nieuwe producten. In die zin zou je zeggen: natuurkundig.
Helemaal zonder chemie gaat het toch niet, want ionen (van het ionrooster) verwijderen zich van elkaar en de vrijkomende ionen worden omringd door watermoleculen.
En soms doet zich wel degelijk een reactie voor tijdens het oplossen.
Je ziet, het is niet altijd helemaal 100% duidelijk.
Opdracht 07-06
Een macromolecuul kan reageren met een klein ion in de molverhouding 1 : 1. Maak een schatting van de massaverhouding.
Antwoord:
Stel dat het macromolecuul opgebouwd is uit zoveel atomen dat de molecuulmassa bijvoorbeeld 20.000 is. Dat is best mogelijk in de praktijk.
Het kleine ion kan bijvoorbeeld een massa hebben van 40 (zou Ca2+ kunnen zijn).
Met een molverhouding van 1 : 1 wordt de massaverhouding hier 20.000 : 40 = 500 : 1
een halve kilo van de macromoleculaire stof reageeert dan met één gram ion.
Opdracht 07-15
Hoeveel (massa en volume) kooldioxide worden gevormd bij de volledige verbranding van 4,01 g methaan?
Antwoord:
| Hoeveel (massa en volume) kooldioxide wordt gevormd bij de volledige verbranding van 4,01 g methaan? | |
| 1 | CH4(g) + 2 O2(g) |
| 2 | Onderstreep die stoffen waarover je gegevens hebt of waarover iets wordt gevraagd.
CH4(g) + 2 O2(g) |
| 3 | Dus, 1 mol CH4(g) reageert met 1 mol CO2(g) (verhouding is 1:1) |
| 4 | 16 gram CH4(g) produceren 44 gram CO2(g) (hier passen we de molecuulmassa's toe) |
| 5 | in werkelijkheid hebben we niet 16 gram, maar slechts 4 gram voor de verbranding.
De in te voeren factor is dan: 4/16. (in dit geval is dat toevallig: delen door vier) 4/16 x 16 gram CH4(g) produceren 4/16 x 44 gram CO2(g) tenslotte: standaardomstandigheden wil zeggen: bij temperatuur van 25oC en druk van 1 atm. Dan is 1 mol gas = 22,4 liter 1/16 x 44 = 11 gram CO2(g) wordt geproduceerd, dat is gelijk aan 4/16 mol = 4/16 x 22,4 liter CO2(g) = 5,6 liter |
Opdracht 07-22
3 mol Chloor en 150 gram IJzer worden samengevoegd en vormen IJzer(III)chloride.
Welk reagens is het limiterende? ofwel: welk reagens gaat helemaal op?
Antwoord:
| 1 | kloppende vergelijking: 2Fe(s) + 3Cl2(g) à 2FeCl3(s) |
| 2 | Over Fe e Cl2 zijn gegevens en over ijzer(III)chloride is geen enkele vraag, dus, we gaan alleen met die twee reagentia aan het rekenen.
2Fe(s) + 3Cl2(g) à 2FeCl3(s) |
| 3 | MOLverhouding is: 2 : 3 of beter: 3 mol chloor reageert met 2 mol ijzer. |
| 4 | Het Chloor is in mol gegeven dus is er geen omrekening nodig van eenheid
Het IJzer is gegeven in grammen: 3 mol chloor reageert dus met 2x55,8 = 111,6 gram ijzer (zie tabellenboek, tabel V) |
| 5 | Er is in werkelijkheid 3 mol chloor en 150 gram ijzer. Dus blijft er ijzer over. Het chloor is de beperkende factor. |
Opdracht 07-23
Stikstof en Waterstof reageren in een directe reactie met elkaar en vormen het product ammoniak, in een industriele reactor met katalysator.
Er vormen zich 1000 gram product (ammoniak) met een rendement van 97,8%
De molecuulmassa van ammoniak = 17,0
Hoeveel mol reagens zijn nodig.
Antwoord:
| 1 | de kloppende reactievergelijking: N2(g) + 3H2(g) à 2NH3(g) |
| 2 | we moeten de reagentia berekenen en we kennen de producten, dus alle stoffen doen mee aan de berekening:
N2(g) + 3H2(g) à 2NH3(g) |
| 3 | Molverhouding: 1 : 3 : 2 of liever gezegd:
3 mol waterstof reageert met 1 mol stikstof en vormt 2 mol ammoniak.
|
| 4 | 3 mol waterstof reageert met 1 mol stikstof en vormt 2x17 = 34 gram ammoniak
van de 1000 gram product is 978 gram zuivere ammoniak; er wordt dus 978 g ammoniak gevormd in plaats van 34 gram. De factor is dus 978/34 = 28,8. |
| 5 | kortom: 28,8x3 = 86,4 mol waterstof reageert met 28,8x1 = 28,8 mol stikstof en vormt 28,8 x 34 = 1000 gram 97,8%ammoniak. |
Opdracht 07-25
Zal de condensatie van waterdamp exotherm of endotherm zijn? Leg je antwoord uit.
Antwoord:
Condensatie betekent dat de gasvormige watermoleculen (die dus los van elkaar bewegen) nu samengaan, bij elkaar komen en zo vloeibaar water vormen.
Samenvoegen is volgens de vuistregel exotherm. Condensatie moet dus energie opleveren; de omgeving wordt warmer.
Opdracht 07-27
De bindingsenergie van het stikstofmolecuul is erg hoog. Leg dat uit.
Antwoord:
De binding tussen de twee N-atomen is drievoudig. Het kost erg veel energie om zo'n drievoudige binding te verbreken (dus het maken van deze binding levert veel bindingsenergie op).
Controleer dit in de tabel.
Opdracht 07-34
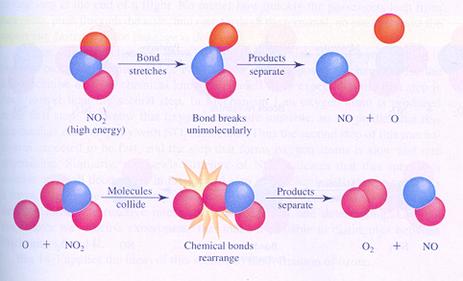
hieronder zie je twee mogelijke mechanismen van de reactie (je kunt ook zeggen: verschillende stappen van de reactie) tussen moleculen van stikstofdioxide
In geval I botsen twee moleculen en zo start de reactie.
In geval II splitst één molecuul en één van de producten van die splitsing botst met een ander molecuul.
Vergelijk de twee mechanismen en zoek de verschillen.
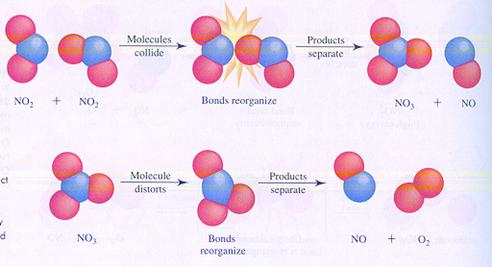
geval I
geval II
Antwoord:
Beide reacties ondergaan een botsing tussen twee deeltjes, maar wel op verschillende momenten in het mechanisme.
Er is geen informatie over de snelheid van de tussenstappen.
Dus is het moeilijk de snelheden van de twee mechanismen te vergelijken.
In beide gevallen wordt NO eerder gevormd dan O2.
Opdracht 07-36
Waarom is het niet mogelijk om de concentratie van de reagentia constant te houden tijdens een reactie?
Antwoord:
De reagentia reageren nu eenmaal tijdens een reactie en dus worden hun concentraties automatisch lager.
(Tenzij natuurlijk je tijdens de reactie voortdurend nieuwe reagentia toevoegt}
Opdracht 07-45
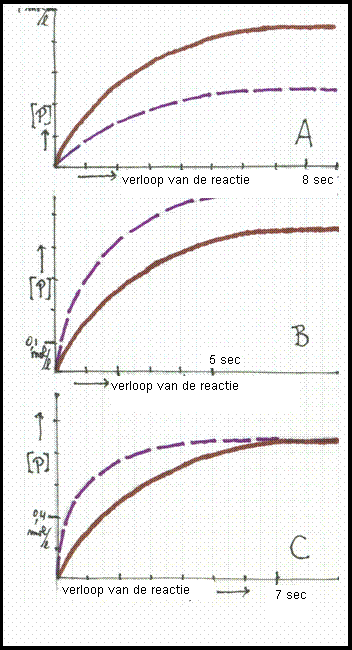
De drie diagrammen vertonen grafieken:
‘concentratie van het product in mol/l’ versus ‘verloop van de reactie in seconden’.
De twee grafieken verschillen steeds alleen in temperatuur, en wel zo dat de ononderbroken lijn de reactie vertoont bij de laagste temperatuur.
Kies het juiste diagram en leg je keuze uit.
Antwoord:
Diagram C geeft de juiste grafiek. Uiteindelijk is de hoeveelheid product gelijk. Werken bij hogere of lagere temperatuur beïnvloedt alleen de snelheid waarmee de producten worden gevormd. De onderbroken lijn laat zien dat bij hogere temperatuur de producten in minder tijd worden gemaakt.
Opdracht 07-47
- We kunnen alle chemische reacties verdelen in verbindings- en ontledingsreacties. Leg dit uit.
- Je kunt de reacties ook op een andere manier in twee soorten indelen. Hoe?
Antwoord:
Bij elke reactie worden bindingen verbroken en nieuwe bindingen gemaakt. Als deeltjes meedoen aan een reactie moeten ze eerst vrij zijn om vervolgens nieuwe bindingen aan te gaan.
De andere manier is natuurlijk de indeling in exotherme en endotherme reacties.
Opdracht 08-07
Enkele evenwichten in het menselijk lichaam - in dit geval in het bloed - zijn:
- HHb + O2
 HbO2 +H+
HbO2 +H+
- CO2 + H2O
 H2CO3
H2CO3
- H2CO3
 H++ HCO3-
H++ HCO3-
Wat voor problemen kunnen personen met een te lage pH-waarde van het bloed ondervinden?
Antwoord:
Okay, stel iemand heeft een te lage pH-waarde in het bloed. D.w.z., het bloedmilieu is wat zuurder dan normaal. Er zijn meer H+-ionen dan normaal.
De evenwichten i en ii voelen dat meteen en verplaatsen zich naar de linkerkant (volgens de regels van Chatellier e Van’t Hoff). In geval iii zal er extra H2CO3 gevormd worden wat op zijn beurt weer invloed heeft op evenwicht ii, en dat gaat dan nog méér naar links. De consequenties zijn:
- Het hemoglobine gaat minder zuurstof opnemen
- Het bloed gaat minder kooldioxide transporteren.
En als het echt ernstig wordt kan het dodelijk zijn.
Opdracht 08-12
Is de volgende bewering waar of vals? Leg je antwoord uit.
"Als een enzym een evenwicht beïnvloedt, dan verandert de waarde van de evewichtskonstante K"
Antwoord:
Een enzym mag je beschouwen als een 'bio-katalysator'.
Je hebt inmiddels geleerd dat een katalysator nooit de waarde van K beïnvloedt, dus ook een enzym doet dat niet.
De bewering is dus onwaar.
Opdracht 08-17
Welke waarde heeft K:
- Als er sprake is van zeer sterke producten en zeer zwakke reagentia
- Als er zeer zwakke producten zijn en zeer sterke reagentia
Antwoord:
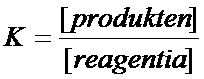
"Sterke producten" betekent dat die producten een grote neiging hebben om te reageren en de (zwakke) uitgangsstoffen (reagentia) terug te vormen.
In die situatie , als het evenwicht bereikt is, zal dus de product-concentratie laag zijn en de reagentia-concentratie juist hoog.
In de formule voor K zal dus het quotient een zeer lage waarde hebben.
In de omgekeerde situatie geldt ook de tegengestelde conclusie: K zal een zeer grote waarde hebben
Je kunt dus ook zeggen: Als bij een evenwicht veel product aanwezig is zal de K-waarde groot zijn en in geval van weinig producten zal de K-waarde klein zijn.
Opdracht 08-24
Bewering: "Kokend zuiver water (dus bij temperatuur van 100 oC) heeft geen pH=7"
Leg uit waarom deze bewering waar of onwaar is.
Antwoord:
Het waterevenwicht heeft als alle evenwichten een thermodynamisch effect.
D.w.z. dat de dissociatie van water energie kost en het omgekeerde levert energie op.
Verwarming stimuleert de endotherme reactie, dus de dissociatie. (Dissociatie probeert de temperatuursverhoging tegen te werken).
Dus bij hogere temperaturen zal water méér hydronium- en hydroxide-ionen bevatten.
Méér hydronium ionen (H3O+) betekent automatisch, volgens de wiskunde, dat de pH kleiner zal worden.
De bewering is dus waar.
Opdracht 09-01
De neutralizatie van verdund zoutzuur met een oplossing van natriumhydroxide kan als volgt worden weergegeven:
H+(aq) + OH-(aq)
Leg je antwoord uit.
Antwoord:
Welk zuur dan ook, het kan H+-ionen afstaan, en zoutzuur kan dat heel gemakkelijk.
Natriumhydroxide opgelost in water is in ionen gesplitst, geïnizeerd in Na+ en OH-. Deze ionen ondergaan dus in het geheel geen verandering.
Het enige wat hier verandert is dus die reactie tussen H+(aq) met OH-(aq), waarbij water gevormd wordt.
De bewering is dus juist.
Opdracht 09-06
Kies het juiste antwoord en leg je keuze uit.
- bevat geen zouten
- Bevat gelijke hoeveelheden H+ en OH-
- bevat geen H+ en geen OH-
- bevat geen zuur of base
1. Zouten zijn samengesteld uit ionen en deze ionen kunnen een zuur of basisch karakter hebben, maar som ook niet.
2. Een wateroplossing heeft altijd wel wat ionen H+ en OH-
Dus: Een neutrale oplossing met een temperatuur van 25º Celcius moet gelijke hoeveelheden H+ en OH- bevatten
Opdracht 09-07
- Zal de volgende stof een zuur zijn of niet? ofwel, zal het deeltje in staat zijn protonen af te staan?
- Probeer in je antwoord ook het polaire karakter van de bindingen in het molecuul mee te nemen
CH4 |
H2S |
NH3 |
H2O |
HCOOH |
HCl |
HCN |
|
H
| H - C - H | H |
H
/ S \ H |
H H
\ / N | H |
H
\ O | H |
OH
/ H - C = 0 |
H - Cl | H - C ≡ N |
Antwoord:
CH4: Een zeer symmetrisch molecuul (een zgn tetraëder) zonder enige polariteit in de bindingen.
Er zijn geen vrije elektronenparen. En er is geen enkele neiging om af te staan of op te nemen.
H2S: Een klein verschil in elektronegativiteit; er zijn twee vrije elektronenparen.
Er zal een zwakke neiging zijn om H+ af te staan; H2S is daarom een zeer zwak zuur.
Verderop zullen we nog het verband zien tussen de plaats van S in het periodiek systeem en de zuurte van deze stof.
NH3: Duidelijk wat meer verschil in elektronegativiteit; één vrij elektronenpaar.
In het molecuul overheerst de neiging om een proton te paken, op te nemen. Het is een zwakke base.
H2O: De elektronenverdeling is gelijk aan die van H2S, maar er is een groter verschil in elektronegativiteit. Het watermolecuul kan net zo goed afstaan als opnemen (dus het is amfoteer); maar het is zowel als zuur en als base zeer zwak.
HCOOH: De binding O - H in de carboxylgroep heeft een flinke polariteit; de O heeft twee vrije elektronenparen, de H kan min of meer afgestaan worden. De stof is een zuur (en nog wel één van de sterkere uit de koolstofchemie).
HCl: Zeer sterk zuur. De binding tussen H en Cl is zeer polair en is gereed om H+ionen af te staan.
HCN: Weinig polariteit tussen H en C, maar de aanwezigheid van N veroorzaakt een kleine neiging om protonen af te staan. Het is daarom een zwak zuur.
Opdracht 09-12
Is dat logisch?: Kationzuren zijn - in het algemeen - oplossingen met meerwaardig positieve metaalionen.
Antwoord:
Meerwaardige positieve ionen bezitten een flinke (positieve) lading. Rondom deze ionen bevinden zich dan watermoleculen met Hδ+-atomen.
Hoe meer positieve centrale lading des te meer afstotende kracht er zal zijn op de Hδ+ van het watermolecuul.
Geheel in overeenstemming met dit verschijnsel zal dus dit complexe geheel in staat zijn om -ionen af te staan, makkelijk of moeilijk.
Opdracht 09-16
Geef een organische stof die een tweewaardige base is (diprotonisch).
antwoord:
een mooi voorbeeld is het ion: oxalaat: C2O42-
Dit ion kan twee protonen opnemen en is dus een tweewaardige base uit de koolstofchemie.
Opdracht 09-24
- HA + H2O
 H3O+ + A-
H3O+ + A-
- A- + H2O
 HA + OH-
HA + OH-
Welke zijn dat?
Antwoord:
De geconjugeerde paren zijn:
- HA en A-
- H2O en H3O+
- H2O en OH-
Opdracht 09-27
Leg uit of de volgende zouten eventueel de mogelijkheid hebben om protonen af te staan of op te nemen:
natriumcarbonaat en calciumwaterstofcarbonaat.
Antwoord:
Na2CO3 is opgebouwd uit de ionen Na+ en CO32-. Als je dit zout in water oplost komen alle ionen vrij; de stof is goed oplosbaar.
Na+ doet niets met water en vormt geen zuur of base.
CO32- echter is een ion dat met water reageert, daar H+ ionen uithaalt, en dan blijft er van dat water OH- over, die H+ kunnen opnemen. Een oplossing met deze carbonaat-ionen zal dus basisch reageren.
Kortom, een oplossing van natriumcarbonaat (=soda) zal basisch reageren en een pH-waarde boven de 7 hebben.
Calciumwaterstofcarbonaat. heeft de formule Ca(HCO3)2 en zal in water oplossen (alle waterstofzouten zijn oplosbaar). Daarbij vormen zich de ionen Ca2+ en HCO3-.
Calciumionen hebben praktisch geen invloed op de pH van een oplossing, ofwel, is nauwelijks zuur of basisch. HCO3- echter is een ander verhaal: Dit ion is amfoteer; kan protonen opnemen (en H2CO3 vormen) en kan protonen afstaan (en CO32- vormen). Als een ion zowel zuur als basisch kan reageren is de vraag welke neiging de sterkste is: de zure of de basische. Onderzoeken we de zuurkonstante en de basekonstante van HCO3-, want wie het grootst is die wint.
In tabel I vindt je de waarden:KA = 10-10 en KB= 10-8. De basekonstante is dus 100 x zo groot, ofwel: als base is het ion sterker dan als zuur. Dit ion in water zal daarom een (zwak) basisch milieu veroorzaken met een pH groter dan 7.
Opdracht 09-33
Een zekere oplossing toont verschillende kleuren met indikatoren:
Lakmoes wordt blauw; Broomthymolblauw wordt ook blauw en fenolftaleïne wordt kleurloos.
Binnen welke grenzen bevindt zich de pH van deze oplossing? Leg uit hoe je aan je antwoord komt.
Antwoord:
| indikator | zure kleur | basische kleur |
| Lakmoes | rood tot pH 5,5 | blauw vanaf pH 8,0 |
| Broomthymolblauw | rood tot pH 1,2 | geel van pH 2,8 tot 6,0 en blauw vanaf 7,6 |
| Fenolftaleíne | kleurloos tot pH 8,2 | violet vanaf pH 10 |
- Lakmoes wordt blauw; dus de pH moet groter zijn dan 8,0
- Broomthymolblauw wordt ook blauw; dus moet de pH groter zijn dan 7,6
- Fenolftaleïne wordt kleurloos; dus moet de pH kleiner zijn dan 8,2
Opdracht 09-38
- Je hebt 500 ml oplossing van 25 graden Celcius van 0,1M NaAc (natriumacetaat). Toevoeging van 2 ml 2M HCl verlaagt meteen de pH van 8,87 naar 3,68
- Diezelfde toevoeging aan 500 ml buffermengsel van 0,1M HAc en 0,1M NaAc verlaagt de pH slechts van 4,74 naar 4,68
- Voeg je aan datzelfde buffermengsel niet zuur, maar 2 ml 2M NaOH toe, dan stijgt de pH slechts een heel klein beetje.
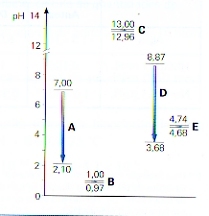
In de figuur zie je net zulke veranderingen: vijf keer wordt er 2 ml 2M HCl toegevoegd aan 500 ml
- zuiver water
- een oplossing van 0,1M sterk zuur
- een oplossing van 0,1M sterke base
- een oplossing van 0,1M zwakke base
- een buffermengsel
- controleer de beweringen van I en II hierboven door berekeningen met de bufferformule.
- bereken de verandering van pH van bovenstaande toevoeging (III) van 2 ml 2M NaOH aan 500 ml buffer 0,1M NaAc/HAc
- controleer en verklaar de gegevens in het diagram.
a.
Je hebt 500 ml oplossing van 25 graden Celcius van 0,1M NaAc (natriumacetaat). Toevoeging van 2 ml 2M HCl verlaagt meteen de pH van 8,87 naar 3,68 Je hebt 2 ml 2M HCl. Dat wil zeggen: HCl heeft een concentratie van 2 mol/l = 2·10-3mol HCl/ml en dus 4·10-3mol HCl/2 ml
Kortom: je voegt 4·10-3mol HCl toe aan 500 ml 0,1M HaAc
0,1M HAc betekent: 10-1mol HAc/l = 0,5·10-1mol HAc/500 ml
Je voegt dus 4·10-3mol HCl samen met 0,5·10-1mol HAc
HCl is sterk en is volledig gesplitst in ionen dus er zijn 4·10-3mol H+ in 502 ml
HAc is zwak en het evenwicht HAc
De concentratie [H+] (of ook [H3O+] is dus 4·10-3mol H+ / 502 ml = 1000/502 · 4·10-3mol H+ / l = 0,002008 mol/l → pH = 3-log2,008 = 3-0,303 = 2,67
b.
Diezelfde toevoeging aan 500 ml buffermengsel van 0,1M HAc en 0,1M NaAc verlaagt de pH slechts van 4,74 naar 4,68, dus een verlaging met slechts 0,06
Je voegt dus 2·10-3mol HCl toe, maar nu aan een buffermengsel.
Het buffermengsel vóór de toevoeging heeft een pH die je volgens de bufferformule kan berekenen:
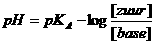
De waarde van pKA van de buffer azijnzuur-acetaat vind je in tabel I {=±4. In andere tabellen zul je preciesere waarden aantreffen. Laten we hier maar gewoon met 4 rekenen, dat is minder exact dan waar bovenstaande opgave mee gewerkt heeft, maar dat geeft even niks} We vullen de waarde 4 in in de bufferformule.
De concentraties van het zuur HAc en van de base Ac- zijn beide: 0,1. Die waarden vullen we in in de bufferformule. Antwoord: pH = 4
In de bewering moet het zijn 4,74, dus zij passen veel exactere waarden toe van de zuurkonstante. Vandaar.
Voegen we 2·10-3mol H+ toe, dan reageert dat meteen met evenzoveel zwakke base Ac- en wordt er evenzoveel zwak zuur HAc bijgevormd.
De concentraties worden:
[HAc] = 0,05 + 0,002 mol/502 ml = ±0,104 mol/l
[Ac-] = 0,05 - 0,002 mol/502 ml = ±0,096 mol/l
Volgens de bufferformule wordt het nu: pH = pKA - log[zuur]/[base] = 4 - log [0,104 / 0,096] = 4 - log 1,083 = 4 - 0,035 = 3,965
de pH zakt dus met 0,035
De gegeven daling van 4,74 naar 4,68, is een verlaging van 0,06; ook heel weinig, maar onze berekening is gebaseerd op een grove pH schatting van 4. Maar je ziet dat de invloed op de pH door deze toevoeging zeer gering is.
c.
Voeg je aan datzelfde buffermengsel niet zuur, maar 2 ml 2M NaOH toe, dan stijgt de pH slechts een heel klein beetje. Voegen we 2·10-3mol OH- toe, dan reageert dat meteen met evenzoveel zwak zuur HAc en wordt er evenzoveel zwakke base Ac- bijgevormd.
De concentraties worden:
[HAc] = 0,05 - 0,002 mol/502 ml = ±0,096 mol/l
[Ac-] = 0,05 + 0,002 mol/502 ml = ±0,104 mol/l
Volgens de bufferformule wordt het nu: pH = pKA - log[zuur]/[base] = 4 - log [0,096 / 0,104] = 4 - log 0,92 = 4 - -0,035 = 4,035
de pH stijgt dus met 0,035
Opdracht 09-42
Bij de verbindingen met Waterstof doen Koolstof en Silicium van groep 4 niet mee bij de vorming van zuren of basen. Leg dat uit.
Antwoord:
De verbindingen zijn CH4 en SiH4. Het verschil in elektronegativiteit is zeer klein in deze moleculen.
Opdracht 09-44
Zal het volgende mengsel een neutrale oplossing zijn, ja of nee?: 1 mol H2SO4 + 1 mol NaOH in water
Leg je antwoord uit.
Antwoord:
Bij samenvoegen van 1 mol zwavelzuur en 1 mol natriumhydroxide zullen die twee meteen reageren (sterk zuur met sterke base) volgens de reactie:
H2SO4 + 2NaOH
Zoals je ziet is de molverhouding 1 : 2. Dat betekent dat je voor een volledige reactie 2 x zoveel loog nodig hebt dan zuur. Terwijl er toch maar van allebei 1 mol wordt gebruikt. Kortom: er is te weinig loog. Slechts de helft van het zwavelzuur wordt geneutraliseerd, de andere helft blijft over en zorgt voor een zure eindoplossing.
Opdracht 09-52
Bij een titratie van 10 ml xM HNO3 waren nodig 19,87 ml 0,0978M NaOH.
De molariteit van de HNO3-oplossing ligt in de buurt van 0,2M, maar precies weten we het niet.
Bereken de exacte molariteit
Antwoord:
In sommige boeken past men hier een wiskundige formule toe: n=cV.
De auteur van deze cursus houdt daar niet zo van. Beter kun je automatische oplossingen, door het simpelweg invullen van formules, vermijden. Je krijgt wel een antwoord en misschien is dat antwoord zelfs goed, maar wat heb je er aan als je er niets van begrijpt?
Veel beter is een goed beeld te hebben van wat er gebeurt bij zo'n titratie en op grond daarvan een heldere berekening uit te voeren.
Bestudeer dus goed de volgende oplossing van het probleem:
Een titratie baseert zich altijd op een chemische reactie die zich tijdens de titratie in het reactievat voltrekt.
In dit geval zal bij opening van de kraan het toegevoegde KOH(aq) meteen gaan reageren met HNO3(aq).
Tijdens dit proces worden producten gevormd: KNO3(aq) + water.
Dus:
- De reactievergelijking: KOH(aq) + HNO3(aq) → KNO3(aq) + H2O(l)
- De MOL-verhouding van de reagentia = 1 : 1 (1 mol KOH reageert met 1 mol HNO3)
- We willen berekenen het aantal mol van HNO3
- We voegden uit de buret 0,0978M NaOH toe, d.w.z. 0,0978 mol NaOH per liter = 0,0978 mmol per ml.
Toevoegen van één ml van het KOH betekent: toevoegen van 0,0978 milimol KOH.
In werkelijkheid voegden we toe 19,87 ml KOH en dat bevat dus 19,87 x 0.0978 mmol KOH = 1,9433 mmol KOH →
tijdens de titratie reageereden (molverhouding 1:1) 1,9433 mmol KOH met 1,9433 mmol HNO3
Deze 1,9433 mmol HNO3 bevonden zich oorspronkelijk in 10 ml van de salpeterzuuroplossing.
→ de concentratie van de salpeterzuuroplossing is dus 1,9433 mmol/10ml
= 1,9433 x 10-3 mol/10 ml
= 1,9433 x 10-3 x 100 mol/l
= 0,1943 mol/l
Conclusie: de getitreerde HNO3-oplossing heeft een molariteit van 0,1943M
Opdracht 09-58
Fenolftaleïne en Methyloranje zijn zuur-base indikatoren. Beide zijn zwakke zuren, maar één is minder zwak dan de ander.
Welke is de zwakste? Leg je antwoord uit.
Antwoord:
We kijken even bij de tabel met indikatoren.
methyloranje rood 3,1 - 4,4 oranje-geel
fenolftaeíne kleurloos 8,2 - 10 carmijnrood
methyloranje heeft een omslagtraject van ongeveer 3 - 4 en fenolftaleïne heeft een omslagtraject van ongeveer 8 - 10
Wat betekent dit voor de sterkte van de indikator:
Indikatoren zijn zelf zwakke zuren (HIn) die protonen kunnen afsplitsen. Het evenwicht is dan: HIn
Methyloranje heeft (in oplossing) een veel lagere pH dan fenolftaleïne en daarom mag je zeggen dat methyloranje gemakkelijker H+ zal afgeven, dus sterker zuur is, of op zijn minst minder zwak.
Opdracht 10-02
Vraag: Hoeveel elektronen bevinden zich in de volgende deeltjes:
Ba2+ SO42- 6C6H12O6 U ?
Antwoord:
Een neutraal Bariumatoom heeft 56 elektronen (in de schillen) en het ion heeft twee elektronen minder;
dus: Ba2+ heeft 56 – 2 = 54 elektronen.
Het sulfaation heeft één zwavel- en vier zuurstofatomen, dus 1x16 + 4x8 = 48 elektronen.
De lading van het ion is 2-, dus er zijn nog twee elektronen extra = 50 totaal.
6 glucosemoleculen hebben:
36 atomen C + 72 atomen H + 36 atomen O = 6 glucosemoleculen: 36 C-atomen + 72 H-atomen + 36 O-atomen =
36x6 + 72x1 + 36x8 = 576 elektronen totaal.
1 atoom uranium heeft 92 elektronen (=atoomnummer).
Opdracht 10-12
Oxidatoren en Reductoren kunnen voorkomen als atoom, molecuul of (complex) ion.
Kies uit tabel X van het tabellenboek voor elke soort een voorbeeld (dus drie verschillende oxidatoren en drie verschillende reductoren) en geef de halfreacties.
Antwoord
- PbO2 + SO42- + 4H + + 2e-
 PbSO4 + 2H2O
PbSO4 + 2H2O
[hier reageert één molecuul (oxidator)] - Cr2O72- + 14H + + 6e-
 2Cr3+ + 7H2O
2Cr3+ + 7H2O
[hier reageert een complex ion (oxidator)] - S + 2H+ + 2e-
 H2S
H2S
[hier reageert het atoom S (oxidator)] - S + 2e-
 S2-
S2-
[hier reageert een enkelvoudig ion (reductor)] - Zn2+ + 2e-
 Zn
Zn
[hier reageert het atoom (reductor)]
Opdracht 10-18
Is het roesten van IJzer een directe redoxreactie, ja of nee? Leg je antwoord uit.
Antwoord:
Het ijzer reageert direct in contact met zuurstof, ook al gaat het langzaam.
Opdracht 10-30
- Leg uit waarom metalen en grafiet elektriciteit geleiden
- Leg uit waarom koper- of ijzerelektroden reageren als reductoren
- Geen een voorbeeld van een gesmolten stof die elektrische stroom kan geleiden
- Leg uit of gedestilleerd water ook elektrische stroom geleidt
Antwoord:
- Metalen zijn samengesteld uit metaalroosters, en die hebben vrije elektronen die vrij kunnen bewegen door de materie. Dit geeft de elektrische geleidbaarheid.
Grafiet is een speciale stof, een vorm van koolstof waarin elk koolstofatoom drie covalente bindingen heeft en één 'overgebleven' elektron. Dat elektron (één per C-atoom) is vrij, kan vrij bewegen in het rooster van grafiet, vergelijkbaar met de elektronen in een metaalrooster.
Vrije ladingen veroorzaken altijd elektrische geleidbaarheid. - Metalen elektrodes hebben metaal-atomen die allemaal weinig elektronen hebben in hun buitenste schil. Ze willen afgeven om een stabiele elektronenstructuur te verkrijgen. Deeltjes die elektronen afgeven zijn reductoren, volgens de definitie.
- Keukenzout, NaCl, smelt bij een temperatuur van boven de 800ºC. In het gesmolten zout heb je vrije ionen die vrij kunnen bewegen, dus: het geleidt.
-
Gedestilleerd water heeft vrijwel geen ionen; dus zal het ook nauwelijks geleiden.
De concentratie van H+ en van OH- is 2x10-7mol/l; dat is erg weinig voor goede geleiding.
Opdracht 10-46
Wat zijn de oxidatoren en reductoren in de volgende reacties (onderzoek dit via de oxidatiegetallen):
- SO2 + Br2 + 2H2O
 2HBr + H2SO4
2HBr + H2SO4
- Mg + H2SO4
 MgSO4 + H2
MgSO4 + H2
- Cu + 2H2SO4
 CuSO4 + SO2 + 2H2O
CuSO4 + SO2 + 2H2O
- 3I2 + 6KOH
 KIO3 + 5KI + 3H2O
KIO3 + 5KI + 3H2O
- S verandert van +4 naar +6
 gaf 2 elektronen af per atoom
gaf 2 elektronen af per atoom
 is reductor
Br veranderde van 0 naar -1
is reductor
Br veranderde van 0 naar -1  nam 1 elektron op per atoom
nam 1 elektron op per atoom
 is oxidator
is oxidator
- Mg veranderde van 0 naar +2
 gaf 2 elektronen af per atoom
gaf 2 elektronen af per atoom
 is reductor
H+ nam 1 elektron op per atoom
is reductor
H+ nam 1 elektron op per atoom  is oxidator
is oxidator
- Cu veranderde van 0 naar +2
 verloor 2 elektronen per atoom
verloor 2 elektronen per atoom
 is reductor
S veranderde van +6 naar +4
is reductor
S veranderde van +6 naar +4  nam 2 elektronen op
nam 2 elektronen op
 is oxidator
is oxidator
- I veranderde van 0 naar +1 (em KIO)
 verloor 1 elektron
verloor 1 elektron
 is reductor
I veranderde van 0 naar -1
is reductor
I veranderde van 0 naar -1  nam 1 elektron op
nam 1 elektron op
 I is ook oxidator
I is ook oxidator
Opdracht 11-04
Wat wordt bedoeld met "thermo-katalytisch"?
Antwoord
Het is een eenvoudige kombinatie van twee reactievoorwaarden:
- Verhoogde temperatuur
- Aanwezigheid van een katalysator
Opdracht 11-08
Wat kunnen we waarnemen tijdens de bedoelde reactie met broomwater?
Antwoord:
- Broomwater heeft een polair en waterig milieu; de kleur is bruin-geel.
- etheen is een apolair gas.
Dus zal het broom tijdens de invoering van het etheengas verdwijnen. Dus ook verdwijnt beetje bij beetje de geel-bruine kleur van het broom, net zolang tot de oplossing kleurloos is.
Opdracht 11-10
Calciumcarbide (C2H2) is een witte en vaste stof met een markante geur, zeer onstabiel, die spontaan reageert met water.
We noemen het vaak "Carbiet".
De producten van de reactie met water: een gas met scherpe geur en een basische oplossing. Als het gas geleid wordt door Broomwater (een verdunde oplossing van Broom) verdwijnt langzaam de gele kleur.
Is er in dit proces sprake van redoxreacties? Leg uit.
Antwoord:
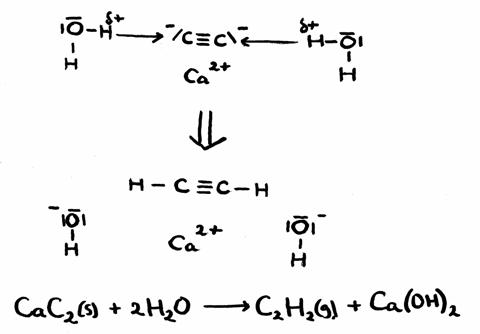
Je ziet de H+-overdracht, wat op een zuur-base reactie wijst.
Er is geen verandering van oxidatiegetal, ofwel, het is geen redoxreactie.
Opdracht 11-12
Propanol kan dienen als uitgangsstof voor propeen, in een eliminatie-reactie.
- Geef deze reactie in structuren
- Wat voor stoffen kunnen helpen bij dit proces?
- Het propanol moet een OH-groep kwijt + een H-atoom van een buur-C.
Zo vormt zich een watermolecuul en een extra binding tussen de twee C-atomen. Dit geeft propeen.
In structuren:
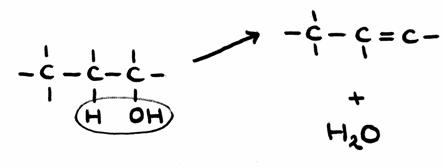
- Gezien de noodzaak om watermoleculen te onttrekken zullen hygroscopische stoffen kunnen helpen bij deze reactie.
/ol>
Opdracht 11-20
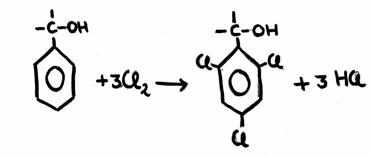
Schrijf in chemische structuren de reactie op van de substitutie van chloor aan tolueen. Geef daarbij de voorwaarden voor de reactie.
Antwoord:
Opdracht 11-21
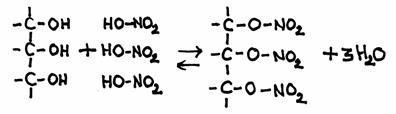
Het product van bovenstaande reactie heeft officieel de naam: glycerol-trinitraat. Maar in de praktijk hoor je vaak een andere naam: nitroglycerine- Geef de reactievergelijking in molecuulformules.
- Leg uit dat die naarm 'nitroglycerine' fout is volgens de UIPAC regels.
Antwoord:- C3H5(OH)3 + 3HNO3
 C3H5(NO3)3
C3H5(NO3)3
- De 'nitro'groep is altijd direct verbonden met een koolstofketen en niet via een O-atoom
Feitelijk hebben we hier een tri-ester van glycerol en salpeterzuur en het product bevat 3 nitraatgroepen (= NO3-).
Opdracht 11-26
Bereken het oxidatiegetal van de C-atomen in de volgende stoffen (invullen in de tabel)
Ethaan ethanol ethanal ethoxi-ethaan ethylethan(o)aat methaan
Antwoord:Ethaan Beide C-atomen zijn -3 ethanol één C-atoom is -3 en de ander is -1 ethanal één C-atoom is -3 en de ander is +1 ethoxi-ethaan Twee C-atomen zijn -3 en twee andere zijn -1 ethylethan(o)aat Twee C-atomen zijn -3, één is +1 en één is +3 methaan Het C-atoom is -4
Opdracht 11-38
Lees de volgende twee beweringen:- Methaanzuur kan gemakkelijk worden geoxideerd
- Ethaanzuur kan gemakkelijk worden geoxideerd
Antwoord:- Methaanzuur = mierezuur heeft een polair C-atoom dat met nog H-atomen, oftewel, het kan nog worden geoxideerd.
- De producten daarbij zijn overigens kooldioxide en water (opmerkelijk!)
- Ethaanzuur heeft wel een polair C-atoom, maar geen H-atoom meer, dus kan niet gemakkelijk worden geoxideerd.
Opdracht 11-53
Een zeer eenvoudig aminozuur is Alanine (2-amino-propaanzuur)- Geef de structuur en leg uit waar en hoe de amfotere reacties plaats vinden.
- Leg uit wat een dubbelion is.
Antwoord:
- twee opties:
- In geval van externe protonoverdracht (met andere zuren of basen):
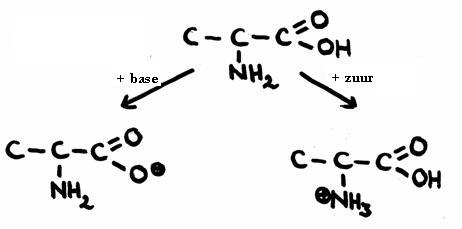
- In geval van interne protonoverdracht (zonder ander zuren of basen):
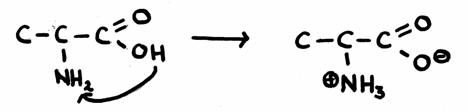
- In geval van externe protonoverdracht (met andere zuren of basen):
- In de onderste tekening, aan de rechterkant, zie je een dubbelion: een structuur die zowel een positieve alsook een negatieve lading bezit.
Opdracht 12-06
Zoek de structuur op van Lysine en leg uit welke pH een oplossing van Lysine ongeveer zal hebben.
Antwoord:
De structuur:
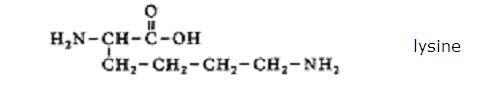
Een oplossing van Lysine zal een pH hebben van ongeveer 9,5 en dus enigzins basisch
Deze waarde is te danken aan de aanwezigheid van twee aminogroepen. Lysine heeft dus één zuurgroep en twee basegroepen.
Het basisch karakter overheerst dus.
Kortom: de pH zal groter zijn dan zeven.
Opdracht 12-10
Laat met structuren de vier vormen zien die Alanine kan aannemen (met en zonder ladingen).
Antwoord:
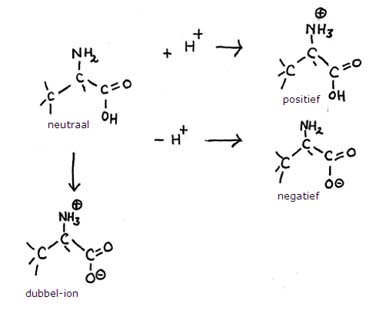
Opdracht 12-13
Stel je een proteïne voor met 1000 eenheden van Valine (dus de monomeer Valine zit er 1000 x in).
Bereken de molecuulmassa.
Antwoord:
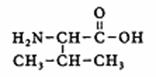
molecuulmassa = 5xC + 2xO + 1xN + 11xH = 117
1000 x 117 = 117.000 (de volledige Valine moleculen)
1000 x 18 – 18.000 (het zich vormende, zich afscheidende water)
molecuulmassa van dit proteïne: 117.000 – 18.000 = 99.000
Opdracht 12-22
Waar of Onwaar::
Om de aanwezigheid van glucose in urine te onderzoeken is de 'enzymatische methode met glucose-oxidase' een specifieker methode dan 'Fehlings' Reagens'.
Antwoord:
Dat is waar. Enzymen - hier het oxidase - zijn vele malen specifieker dan gewone chemische stoffen. Fehlings Reagens reageert met veel meer zwakke reductoren.
Opdracht 12-24
Stel je een situatie voor waarin iemand (bijvoorbeeld door mutatie) de mogelijkheid heeft gekregen om fotosynthese ergens in zijn lichaam te realiseren.
Wat voor consequenties kan dat hebben?
Antwoord:
Deze mens kon wel eens een groene kleur hebben, waarschijnlijk de huid (dus marsmannetjes hebben chlorofyl in de huid!). En dus de mogelijkheid om, onder invloed van de zon, koolzuurgas en water te verwerken tot suiker.
Hij kan zijn eigen glucose aanmaken, waardoor het eten van zetmeel volkomen overbodig wordt.
Er kunnen best nog andere consequenties worden bedacht.
Opdracht 12-33
Laat in een energiediagram zien wat de "activeringsenergie" is van een chemische reactie.
Antwoord:
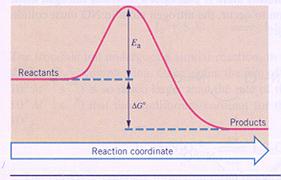
Opdracht 12-38
In het spijsverteringssysteem van de mens zijn verschillende enzymen werkzaam. Elk van hen heeft zijn specifieke pH-optimum (optimale pH-waarde waarbij het enzym het beste functioneert).plaats enzymen pH-optimum In speeksel amilase en maltase 6,6 In de maag peptase, rennase 1,5 - 4 In de pancreas amilase, maltase, lipase, tryptase, polipeptidase 6,6 - 9 In de ingewanden maltase, saccharase, lactase, ereptase 6,6 – 8,5 - Leg de variaties uit in pH-waarden in de vier plaatsen.
- Waarom verschijnt maltase pas aan het eind van de spijsvertering?
Antwoord:- In de maag bevindt zich behoorlijk sterk zuur. In de mond zouden we zo'n pH niet uithouden. In de pancreas en in de ingewanden kan de pH-waarde een beetje variëren, afhankelijk van de te verteren spijzen.
- Maltose - in het algemeen - is een product van zetmeelhydrolise. Het kost tijd om dat zetmeel klein te krijgen.
Opdracht 12-40
Leg uit hoe je aan de volgende uitdrukking kan komen:

uitgaande van vooronderstelling 1.
Antwoord:
Vooronderstelling 1:
Een "steady state", een stationaire fase waarin de concentratie van het intermediair ES niet verandert: de vorming van complex ES vindt plaats met dezelfde snelheid als het verdwijnen (de degradatie) ervan.
dat betekent:

Opdracht
Opdracht
Opdracht
Opdracht
Opdracht
Opdracht
Opdracht