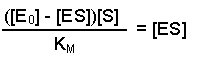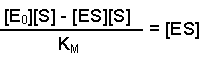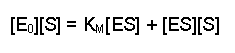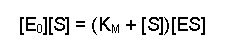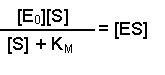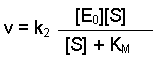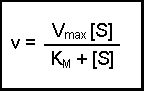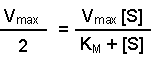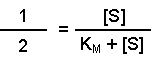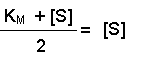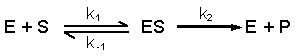|
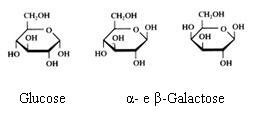
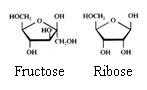
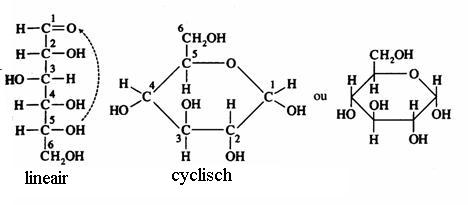
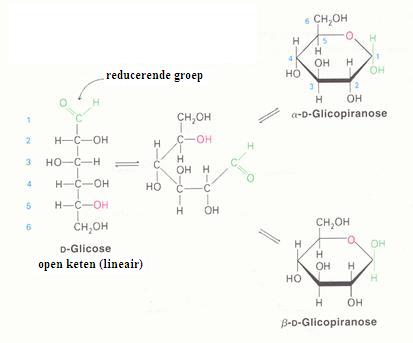
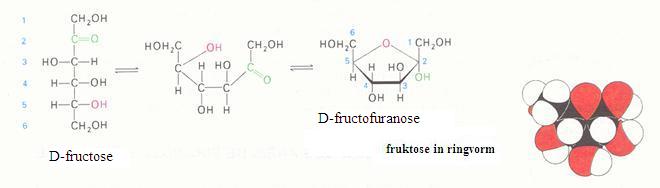
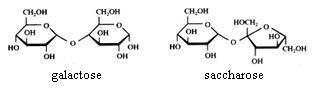
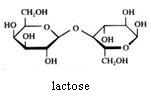
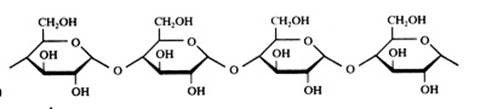
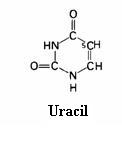
2.1 Strukturen van koolhydraten |
|
|
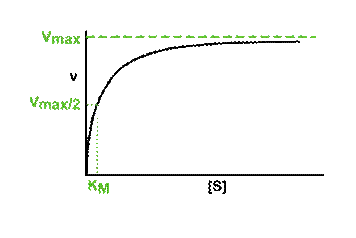
5d. Optimale werking en denaturatie van enzymen |
|
| aminozuren dienen vooral om vetten te produceren; | W / O |
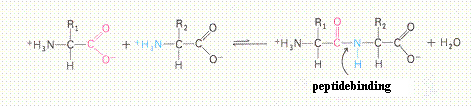
| Er zijn 10 voor de mens essentiŰle aminozuren; | W / O |
| Alle aminozuren hebben een amfoteer karakter | W / O |



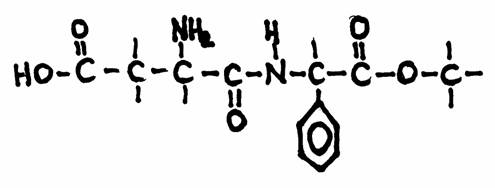
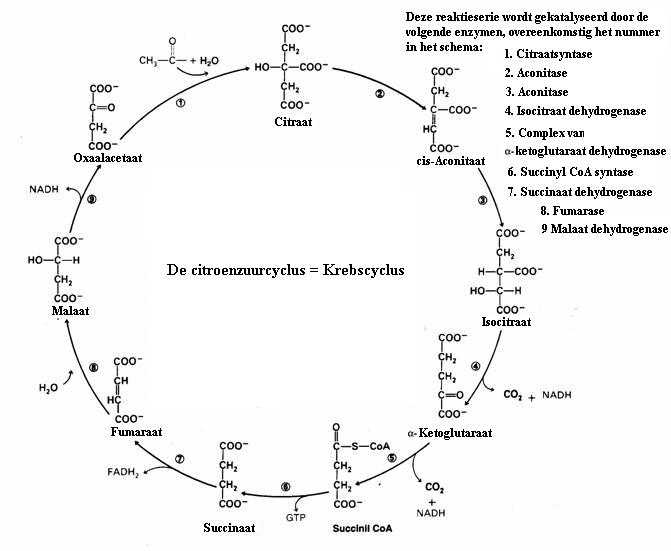
| Citraat | oxaal acetaat | ||||
| C6H5O72- | + | H2O | C4H2O52- | + 2CO2 + 5HĚ |



| Oxireductases | katalyseren redoxreacties (bijvoorbeeld:. glucose-oxidase) |
| Transferases | transporteren functionele groepen van een gever naar een ontvanger. |
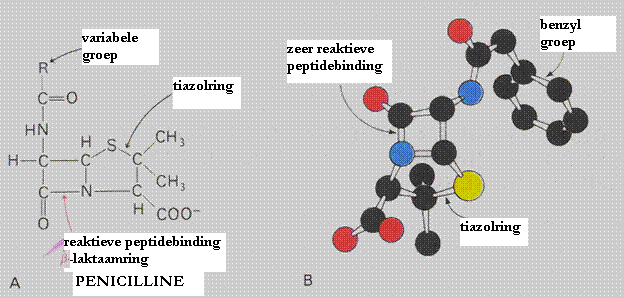
| Hidrolases | splitsen moleculen (voorbeeld: peptidases, proteases) |
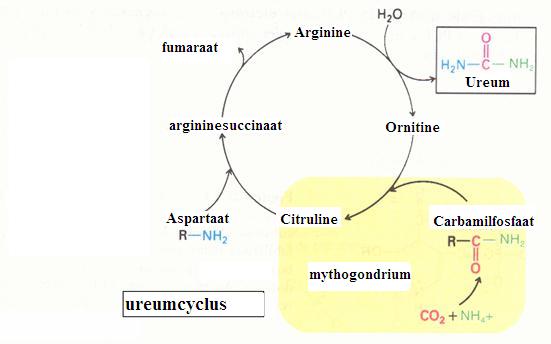
| Liases | onttrekken of voegen juist toe: bepaalde functionele groepen (voorbeeld. decarboxilase) |
| Isomerases | veranderen isomeren (mutase) |
| Ligases | verbinden verschillende moleculen met elkaar (piruvaatcarboxilase) |
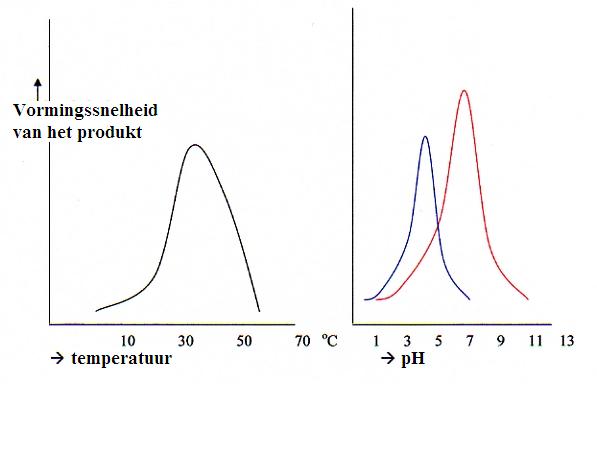
| Pepsine | 1,5 | in de maag |
| Amilase | 6,6 | in speeksel |
| Lipase | 8,0 resp. 7,0 | in de pancreas resp. in de darmen |
| Saccharase | 7,0 | in de maag |
| waar: | enzym | pH-optimum |
| in het speeksel | amilase e maltase | 6,6 |
| in de maag | peptase, rennase | 1,5 - 4 |
| in de pancreas | amilase, lipase, tryptase, polipeptidase | 6,6 - 9 |
| in de ingewanden | maltase, saccharase, lactase, ereptase | 6,6 - 8,5 |
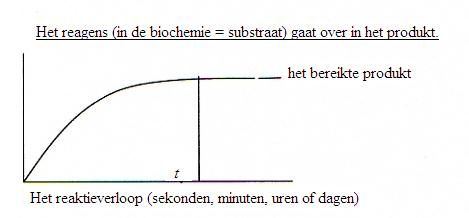


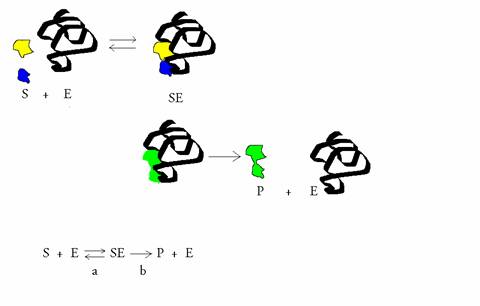



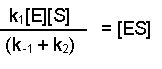
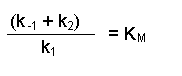
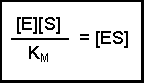 (Equation 2)
(Equation 2)